SEL-212
pegadricase + ImmTOR™
SEL-212は、ペグ化尿酸オキシダーゼ(ペガドリカーゼ;SEL-037)と抗薬物抗体(ADA)の産生を阻害するImmTOR™の新規の月1回併用投与療法剤です。本適応症に関しては、ImmTORには尿酸オキシダーゼ特異的なADAの阻害剤であるSEL-110.36が含まれています。これによって、慢性痛風治療用の他の生物学的製剤(AmgenのKRYSTEXXA®/ペグロチカーゼなど)に対するADAの存在下における有効性および忍容性の低下という制限に対処できます。

SEL-212 一覧
- Sobi
- Cartesian Therapeutics Inc/Selecta Biosciences Inc
- ImmTOR™(シロリムス[SEL-110.36]を封入したナノ粒子)とペグ化尿酸オキシダーゼ(ペガドリカーゼ;SEL-037)の併用
- 慢性痛風の治療のための月1回静脈内投与
- 1970万人が2023年にG7市場で慢性痛風と診断されています
なぜDrug to Watchなのか?
SobiはSelecta Biosciences Inc(2023年11月にCartesian Therapeutics Incが買収)から1億ドルでSEL-212のライセンス供与を受け、中国本土を除く全市場での開発、規制および商業活動を行っています。欧州および日本市場においては、SEL-212は治療抵抗性の慢性痛風に対する初の治療薬となると期待されています。
SEL-212は、難治性の慢性痛風における血清尿酸値を低下させることにより、未治療のまま放置した場合に痛風発作および関節変形を引き起こす可能性のある有害な組織尿酸塩沈着を減少させるようデザインされています。投与では、ImmTOR (SEL-110.36)に続いてSEL-037を注入します。第3相試験の結果からは、難治性の慢性痛風の治療における主な競合薬であるKRYSTEXXAと同等の有効性および安全性が示されています。しかしSEL-212は投与頻度が少なく、免疫調整剤は同時投与されますが、KRYSTEXXAでは、免疫調節のために必要に応じてメトトレキサートの追加投与が必要となる可能性があります。
BLAの段階的申請は、ピボタル第3相DISSOLVE I試験およびDISSOLVE II試験の結果に基づいて行われています。
-
選択基準および治療レジメンはいずれのRTCでも同一です。
-
従来の治療法(キサンチンオキシダーゼ阻害剤[XOI]、尿酸排せつ薬)では難治性の慢性痛風を有し、過去にペグ化ウリカーゼをベースとした治療を受けたことのない成人(19歳~80歳)
-
治療群(28日ごとに6カ月間投与)
-
低用量SEL-212:0.1 mg/kg SEL-110.36に続いてSEL-037
-
高用量SEL-212:0.15 m/kg SEL-110.36に続いてSEL-037
-
プラセボ
-
DISSOLVE I(米国);n=112
-
試験期間の80%以上において血清尿酸値の6 mg/dL未満への低下を達成して維持:48% vs 56% vs 4%
-
DISSOLVE II(国際共同);n=153
-
試験期間の80%以上において血清尿酸値の6 mg/dL未満への低下を達成して維持: 40% vs 46% vs 11%
-
両試験の実薬投与群において、軽度~中等度の口内炎(3.4% vs 9.2%)および注入反応(4.5% vs 3.4%)が認められた。重篤なTEAEにはアナフィラキシーおよび痛風発作が含まれた(実薬治療を受けた全参加者の3.4%)
審査・承認状況
2024年3月
- ファストトラック指定:米国FDA
2024年7月
- BLA審査段階:米国FDA
上市年(実績、予測)
- 2025年: 米国
- 2026年: EU、日本
Drug Timeline & Success Rates
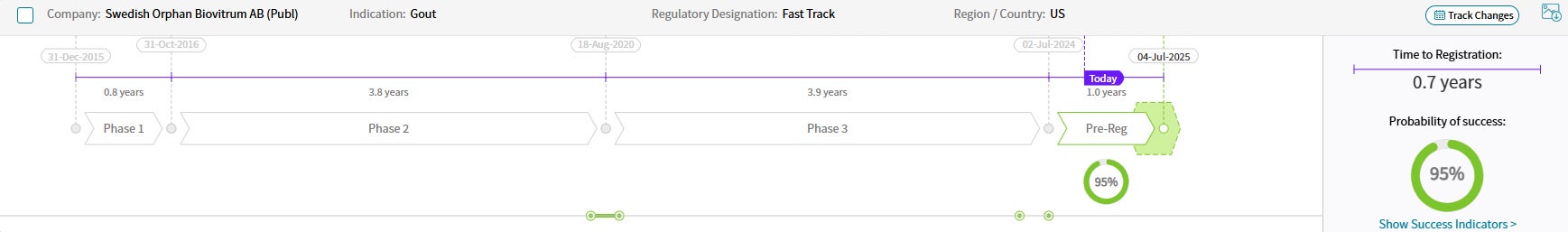
出典: Cortellis Competitive Intelligence, Drug Timeline & Success Rates Prediction current as of October 31, 2024
SEL-212は痛風市場にどのような影響を与えるのか?
-
急性および慢性痛風治療薬の主要市場売上高は、主として新規治療薬の上市および普及に加え、予測期間中の痛風の発生率および有病率の増加によって、2023年の36億ドルから2033年には86億ドルに増加すると予測されます。
-
しかしその市場価値は、後期開発にある薬剤の数が限られている点、ほとんどの痛風患者を効果的に治療できる安価なジェネリック製品が利用可能である点から、制限される可能性もあります。ジェネリック製品は安価で、満足のできる有効性が得られ、医師も使用に慣れているため、今後も標準治療薬として使用され続ける可能性が高いと考えられます。
-
一方、特に慢性痛風市場では、SEL-212はKRYSTEXXAを約10%上回ると予測される高い価格に設定されており、他の治療法では難治性の慢性痛風に対する使用という位置を確立できていることから、大幅な売上増加をもたらすことが期待されます。
-
SEL-212は、主要な競合薬である KRYSTEXXAと同様の有効性および安全性プロファイルを提供し、投与頻度が低く、免疫調整剤と同時に投与できるため、KRYSTEXXAに対する競合優位性を獲得できる可能性もあります。KRYSTEXXAが上市後最初の数カ月間で5億700万ドルの売上を達成したことから、SEL-212の大きな可能性が示唆されます。
SEL-212はどのような治療上のギャップを埋めるのか?
米国では、KRYSTEXXAが標準治療に反応しない慢性痛風に対する唯一の選択肢となっていますが、欧州および日本では現在承認されておらず、難治性の慢性痛風患者の治療には大きなギャップがあることが示されています。治療抵抗性の慢性痛風はしばしば疼痛を伴い衰弱させるもので、年間数回の発作と尿酸結晶の結節性腫瘤(痛風結節)が生じる可能性があります。現在KRYSTEXXAが使用されている市場では、KRYSTEXXAが隔週投与でありメトトレキサートと併用する必要性があるのに対して、SEL-212は月1回の注入で2つの異なる薬剤を同時に投与ができることから、患者および臨床医から歓迎される選択肢となり得ると考えられます。
ブロックバスターとなるために超えるべきハードルは?
SEL-212はKRYSTEXXAに対する競合的優位性を有する可能性がありますが、標的となる難治性の慢性痛風患者集団が比較的小さいこと(痛風患者の約2%8)、価格がきわめて高いこと、およびKRYSTEXXA(ペグロチカーゼ)のバイオシミラーが 2030年に発売予定であることから、SEL-212の使用は比較的制限される可能性があります。