COBENFY
KarXT; xanomeline and trospium chloride
新規の統合失調症治療薬(Acadia Pharmaceuticals Incのピマバンセリン、Minerva Neurosciences Incのロルペリドンなど)の多くが開発中止となる中、COBENFYの承認は統合失調症治療にとっての転換点となります。COBENFYは、30年以上ぶりに新規の作用機序により承認された統合失調症治療薬です。キサノメリン と塩化トロスピウムの固定用量配合剤であるCOBENFYは、従来のドーパミン経路ではなくM1受容体とM4受容体を選択的に標的としており、ムスカリン受容体拮抗薬の一種であり血液脳関門(BBB)をほとんど通過しない塩化トロスピウム成分により、脳外でのザノメリンのコリン作動性による副作用が最小限に抑えられています。現在、アルツハイマー病に関連する精神病に対するCOBENFYの使用について、確定的な結論を下すには十分なデータが得られていません。しかし、アルツハイマー病に伴う幻覚や妄想の治療に有効であることが示されれば、COBENFYの商業的ポテンシャルは高いと予想されます。

COBENFYについて一覧
- Karuna Therapeutics(Bristol Myers Squibbが買収)
- M1/M4ムスカリン性アセチルコリン受容体デュアルアゴニスト
- 成人統合失調症患者における1日2回経口投与
- 効果不十分な統合失調症患者およびアルツハイマー病に関連する精神病を対象とした開発も進行中
- 約540万人が2024年にG7市場で統合失調症と診断されています
- 約320万人が2024年にG7市場でADに関連する精神病と診断されています
なぜDrug to Watchなのか?
統合失調症のすべての患者に有効な治療法を見出すことは困難な可能性があります。既存の治療薬はいずれも脳内のドーパミンD2受容体シグナル伝達を標的としているため、治療選択肢が制限されており、多くの患者への有効な治療がより困難となっています。COBENFYの承認により統合失調症に対する新たな治療選択肢が追加され、Bristol Myers Squibbにとっては最近の精神神経科領域への再参入の大きな成果となります。Bristol Myers Squibbは、COBENFYを処方された患者をサポートするためにデザインされたプログラムであるCOBENFY Cares™も開始しています。
Bristol Myers Squibbは、PureTech Health plcによって設立されたCOBENFYの開発企業であるKaruna Therapeutics Incを2024年3月に買収しました。1980年代および1990年代に実施された研究では、ムスカリン受容体と統合失調症との関連性が報告されており、ザノメリンに関しては以前にEli Lilly and Co.によりアルツハイマー病および統合失調症を対象とした第2相臨床試験までの開発が行われましたが、用量制限の副作用(消化管副作用など)のため中止されました。この副作用は、ザノメリンによる末梢および脳内のM1およびM4受容体の活性化に起因する可能性が高いと考えられました。血液脳関門を通過しない塩化トロスピウムを加えることで、末梢のM1/M4受容体が阻害され、忍容性の問題が克服される可能性が高くなると考えられます。
COBENFYのFDA承認は、長期安全性および忍容性を評価する3つのプラセボ対照試験および2つの非盲検試験を含むEMERGENT臨床プログラムから得られたデータによって裏付けられており、統合失調症の陽性症状および一定の陰性症状において統計的に有意な減少が示され、プラセボと比較してその効果が際立っていました。
-
EMERGENT-2およびEMERGENT-3:統合失調症成人患者
-
COBENFY vs プラセボ(5週間)
-
陽性・陰性症状評価尺度(PANSS)合計スコアの変化:
-
EMERGENT-2:COBENFYで -21.2、プラセボで-11.6(効果量=0.61)
-
EMERGENT-3:COBENFYで -20.6、プラセボで-12.2(効果量=0.60)
-
臨床全般印象評価尺度-重症度(CGI-S)スコアの変化:
-
EMERGENT-2:COBENFYで -1.2、プラセボで-0.7
-
EMERGENT-3:COBENFYで -1.1、プラセボで-0.6
-
有害事象による投与中止:
-
EMERGENT-2: 7% vs 6% (COBENFY vs プラセボ)
-
EMERGENT-3: 6.4% vs 5.5% (COBENFY vs プラセボ)
-
治療効果がわずか2週間で示されたことから、急性期の病院での使用および外来での継続的使用が推進される可能性があります。
-
両方の試験で最も多く見られた有害事象は、悪心(19% vs 4%)、消化不良(18% vs 5%)、便秘 (17% vs 7%)。嘔吐(15% vs 1%)、高血圧(11% vs 2%)、腹痛 (8% vs 4%)、下痢(6% vs 2%)、頻脈(5% vs 2%)、浮動性めまい(5% vs 2%)および胃食道逆流症(5% vs <1%)でした。
-
注目すべき点として、既存の治療法での典型的な副作用であり、治療中止の原因となる可能性のある、傾眠、体重増加および錐体外路症状(EPS)の割合はプラセボ群と同程度でした。
-
EMERGENT-4:EMERGENT-2またはEMERGENT-3を完了した被験者における非盲検延長試験;中間解析:
-
COBENFYの52週間投与
-
>75%の被験者で ≥30%の症状が改善
-
PANSS合計スコア変化:-33.3
-
CGI-Sスコア変化:-1.7
-
EMERGENT-5:統合失調症の成人外来患者にCOBENFYを最長52週間投与する非盲検試験
-
体重増加、代謝機能障害、錐体外路症状なし
さらに、Bristol Myers Squibbは、現在の非定型抗精神病治療薬で十分な効果が得られない患者に対する補助治療薬としてCOBENFYの評価を行うための第3相臨床試験および延長試験を実施しており、それらの結果を使用してCOBENFYの補助治療薬としてのsNDAを提出する予定です。
-
ARISE:現在の非定型抗精神病治療薬で十分な効果が得られない統合失調症成人患者(米国、欧州、日本など)
-
COBENFY vs プラセボ(6週間)
-
主要評価項目:PANSS合計スコア変化
-
完了予定:2025年2月
アルツハイマー病に関連した精神病(幻覚、強迫観念、徘徊など)に対する追加の第3相臨床試験が進行中。:
-
ADEPT-1:精神病(中等度から重度の妄想または幻覚)を伴う、重症度スペクトル(MMSE)8以上22以下の成人(55~90歳)アルツハイマー病患者
-
COBENFY(最大用量まで漸増)の12週間投与
-
10週目または12週目においてNeuropsychiatric Inventory-Clinician: Hallucinations and Delusions (NPI-C: H+D)がベースラインから≥ 40%低下し、CGI-Cスコアが「改善」または「非常に改善」したレスポンダーを COBENFYまたはプラセボに無作為に割り付け、26週間投与を継続
-
主要評価項目:無作為割付けから再発までの期間
-
完了予定:2026年10月
-
ADEPT-2:精神病(中等度から重度の妄想または幻覚)を伴う、重症度スペクトル(MMSE)8以上22以下の成人(55~90歳)アルツハイマー病患者)
-
COBENFYの14週間投与
-
主要評価項目:NPI-C: H+Dスコア変化
-
完了予定:2025年7月
-
ADEPT-3:ADEPT-1またはADEPT-2を完了した被験者を対象とする非盲検延長投与試験
-
COBENFYの52週間投与
-
主要評価項目:試験治療下で発現した有害事象(TEAE)の発現率
-
完了予定:2026年4月
-
ADEPT-4:無作為化、二重盲検、プラセボ対照、並行群間比較試験
-
COBENFYの最長14週間投与
-
主要評価項目:NPI-C: H+Dスコア変化
-
主要評価項目データ収集完了予定:2026年10月
審査・承認状況
2023年9月
NDA提出:米国FDA(統合失調症)
2024年9月
NDA承認:米国FDA(統合失調症)
上市年(実績、予測)
- 2024年:米国(統合失調症)
- 2026年:中国本土(統合失調症)
- 2027年:米国(AD精神病)、欧州連合(現在の治療で効果不十分な統合失調症)
- 2028年:EU(AD精神病)
- 2029年:中国本土(AD精神病)
2030年に特許存続期間が順次満了すると推定される
Drug Timeline & Success Rates
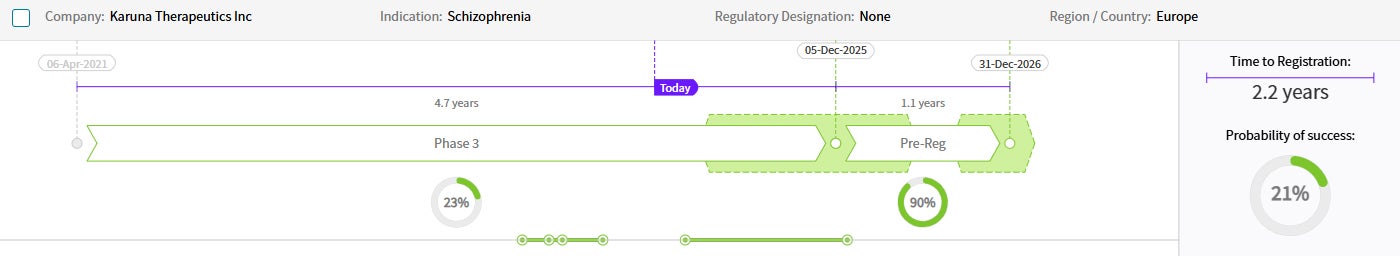
出典: Cortellis Competitive Intelligence, Drug Timeline & Success Rates Prediction current as of October 31, 2024
COBENFYはアルツハイマー病に関連する統合失調症および精神病の市場にどのような影響を与えるのか?
- 統合失調症治療市場は、G7市場においては薬剤治療人口の増加が要因の一部となり、2022年の86億ドルから2032年にはほぼ152億ドルに増加すると予想されます(6% CAGR)。新薬および新興治療薬の売上は、ジェネリック医薬品の市場参入の影響を上回ると予想されます。
- 経口非定型抗精神病薬は、これらの薬剤の有効性、安全性および忍容性が医師に周知されており、その使用に抵抗がないことに加えて、特に初期治療で多用されている薬剤(アリピプラゾール、リスペリドン、オランザピンなど)のジェネリック医薬品が入手可能であることから、統合失調症の主要な第一選択薬として定着し続けると考えられます。
- 新規クラスの2つの薬剤としてCOBENFYおよびイクレペルチン(Boehringer Ingelheim;グリシントランスポーター1型阻害剤)が今後数年間に発売される予定ですが、特にイクレペルチンは、有病率が高くアンメットニーズも高い領域の統合失調症に伴う認知機能障害(CIAS)をコントロールできることから売上により大きな影響を与えると予測されます。
- 一方、COBENFYは、統合失調症治療に対する新規の作用機序(MOA)を有する薬剤のニーズを満たすとされており、他の薬剤では十分な効果が得られない、または副作用が発現する統合失調症患者において、抗精神病薬の補助療法としてだけでなく、単剤療法としても使用されることが期待されています。そして2032年には米国での患者シェアが最大で9.5% に達するとされています。
- 陽性症状または陰性症状を呈し、他の治療薬では十分な効果が得られない、または副作用への忍容性のない患者に対しては、医療保険支払者はまずジェネリック医薬品の処方を奨励し、その後にCOBENFYに切り替えると予想されるため、COBENFYは当初は二次治療以降の単剤療法で使用されると考えられます。
- COBENFYでは2週間で作用発現が見られることが示されているため、入院中の統合失調症を伴う急性精神病患者への処方が可能であり、治療反応性のある患者には外来で治療を継続することが可能です。
- ADに関連する精神病については、独自のMOAを有し、適応がアルツハイマー病に関連する精神病に限定されており、高齢者の死亡リスクに関する枠組み警告が含まれない可能性があることでCOBENFYの使用促進につながる可能性がありますが、低価格で定着している非定型抗精神病薬との競合が予想されます。
- ADアルツハイマー病の有病率、診断率および治療率は、人口の高齢化とともに増加しています。
- COBENFYの成功によって、神経精神病薬に興味を示す大手製薬企業からの大規模な投資を受けているムスカリン受容体拮抗薬パイプラインの継続的な成長が促進される可能性があります。
COBENFYはどのような治療上のギャップを埋めるのか?
既存の統合失調症治療薬は、いずれも脳内のドーパミンD2受容体シグナル伝達を標的とするものであり、幻覚や妄想などの「陽性」症状を一定程度緩和しますが、その効果は患者によって異なります。これら既存の治療薬は、無快感症および感情消退などの陰性症状や、疾患関連の認知障害には有効ではありません。さらに、鎮静、体重増加および運動機能への影響などの副作用は負担が大きく、用量制限につながる可能性があります。また統合失調症が多様な症状を呈する疾患であることが、効果的な治療を行う上での課題となっており、統合失調症患者の20~30%は治療抵抗性あるいは難治性の症状を有しています。これらの患者には高用量または複数の薬剤が処方される場合が多く、そのために副作用のリスクが高まり、服薬コンプライアンス不良につながっています。このため、有効性および安全性プロファイルが改善された抗精神病薬に対する大きなニーズが存在しています。新規MOAを有するCOBENFYは、統合失調症の治療パラダイムに影響を与える可能性があります。
アルツハイマー病に関連する精神病および行動障害は患者にとって苦痛であり、介護者の負担を増大させることから、施設入所に至る主な理由となっています。これらの症状を適応として承認されている薬剤がREXULTI ®(Otsuka America Pharmaceutical Inc.およびLundbeck)のみであることから、依然としてこれらの症状に対する安全で有効な治療薬に対する高いアンメットニーズが存在しています。一方で、医師はこれらの症状に対して、抗精神病薬や催眠薬などその他の薬剤をしばしば適応外で処方していますが、これら薬剤の有効性は限られており、認知症を有する高齢者への抗精神病薬の使用には、脳血管障害の発生率の増加という安全性の懸念が存在しています。
ブロックバスターとなるために超えるべきハードルは?
抗精神病薬の売上は、多くの場合コンプライアンス不良やアドヒアランス不良により限定的とされています。COBENFYでは既存の他の抗精神病薬よりも良好な忍容性が示されていますが、負担が大きく高頻度に投与される治療レジメンへのアドヒアランスが、統合失調症関連の認知機能障害の影響により損なわれる可能性は依然として存在します。また、長い適応期間、ジェネリック抗精神病薬との競合、臨床試験における高い治療中止率および陰性症状を主症状とする患者における成績報告の不足などから、臨床医が第一選択治療としてのCOBENFYの処方に消極的となる可能性があります。さらに、COBENFYの1カ月1,850ドルという薬価は現在市販されているほとんどのジェネリック抗精神病薬の年間薬価を上回っており、特に、統合失調症患者の多くは、疾患の障害特性のために、経済的に困窮し、保険適用がないかまたは限られており、最適な医療を受けられない状況にあることから、COBENFYへのアクセスが制限される可能性があります。欧州および日本での発売は、EMAが統合失調症治療薬の承認に長期間の臨床試験結果を要求していることに加えて、一部の市場ではHTAのプロセスが長期化しており、完了した第3相臨床試験に日本の施設が含まれていないなどの理由で遅れる可能性があります。