SEL-212
pegadricase + ImmTOR™
SEL-212는 ImmTOR™와 월 1회 병용 투여하는 신종 약물입니다. ImmTOR™은 페길화 요산분해효소(pegadricase, SEL-037)와 항약물 항체(ADA) 형성을 억제하는 면역 내성 기술입니다. 이 용도에서 ImmTOR는 요산분해효소 특이적 ADA 항체인 SEL-110.36으로 구성됩니다. 만성 통풍에 대한 다른 생물학적 의약품(예: KRYSTEXXA®, 페글로티타제, Amgen)에 대응하여 개발된 ADA의 효능과 내약성 감소라는 한계를 해결해 줄 수 있는 기술입니다.

SEL-212 개요
- Sobi
- Cartesian Therapeutics Inc/Selecta Biosciences Inc
- IImmTOR™(시롤리무스 캡슐화 나노입자[SEL-110.36]) + 페길화 요산분해효소(pegadricase, SEL-037)
- 만성 불응성 통풍을 치료 목적으로 월 1회 정맥 주입
- 2023년 G7 시장 만성 통풍 유병 증례 1,970만 건
블록버스터 신약 선정 이유
Sobi는 Selecta Biosciences(2023년 11월 Cartesian Therapeutics에 인수됨)로부터 SEL-212를 1억 달러에 라이선스했으며 중국 외 모든 시장에서 개발, 규제 및 상업 활동을 담당하고 있습니다. 유럽과 일본 시장에서 치료 불응성 만성 통풍을 치료하는 첫 약물이 될 것으로 기대를 모으고 있습니다.
SEL-212는 만성 불응성 통풍의 혈청 요산염 수치를 낮춰, 치료하지 않고 방치하면 통풍 발작과 관절 기형을 초래할 수도 있는 유해한 조직 요산염 침착을 줄이는 효과가 있습니다. 투여는 ImmTOR(SEL-110.36)를 순차적으로 주입한 후 SEL-037을 주입하는 순서로 합니다. 임상 3상 결과 만성 불응성 통풍 치료의 주요 경쟁 제품인 KRYSTEXXA와 유사한 효능과 안전성이 입증되었습니다. 다만 SEL-212는 투여 빈도가 적고 면역 조절제와 병용 투여하는 반면, KRYSTEXXA는 필요 시 면역 조절을 위해 Methotrexate를 추가로 투여해야 할 수도 있습니다.
BLA 순차 제출은 중심이 되는 3상 임상시험인 DISSOLVE I과 DISSOLVE II의 결과를 토대로 하였습니다.
-
두 RCT 모두 참여 기준과 치료 요법이 동일했습니다:
-
기존 치료법 (잔틴 산화효소 항체[XOI], 요산 억제제)에 불응하고 이전에 페길화 요산 기반 요법에 노출된 적이 없는 만성 통풍 성인(19~80세)
-
치료군(6개월 동안 28일마다 투여)
-
저용량 SEL-212: 0.1 mg/kg SEL-110.36, 이어서 SEL-037
-
고용량 SEL-212: 0.15 mg/kg SEL-110.36,이어서 SEL-037
-
위약
-
DISSOLVE I(미국); n=112
-
시험 기간의 80% 이상에서 혈청 요산 수치가 6 mg/dL 미만으로 감소하고 이를 유지: 48% vs. 56% vs. 4%
-
DISSOLVE II (글로벌); n=153
-
시험 기간의 80% 이상에서 혈청 요산 수치가 6 mg/dL 미만으로 감소하고 이를 유지: 40% vs. 46% vs. 11%
-
두 임상시험 모두에서 활성 치료 그룹은 경증에서 중등도의 구내염(3.4% vs. 9.2%)과 주입 반응(4.5% vs. 3.4%)을 경험했습니다. 아나필락시스와 통풍 발작(적극적인 치료를 받은 전체 참가자의 3.4%)이 심각한 TEAE로 나타났습니다
심사 및 승인 현황
2024년 3월
- 패스트 트랙 지정: 미국 FDA
2024년 7월
- BLA 순차 제출: 미국 FDA
실제 및 예상 출시:
- 2025년: 미국
- 2026년: E.U., 일본
약물 일정 및 성공 확률
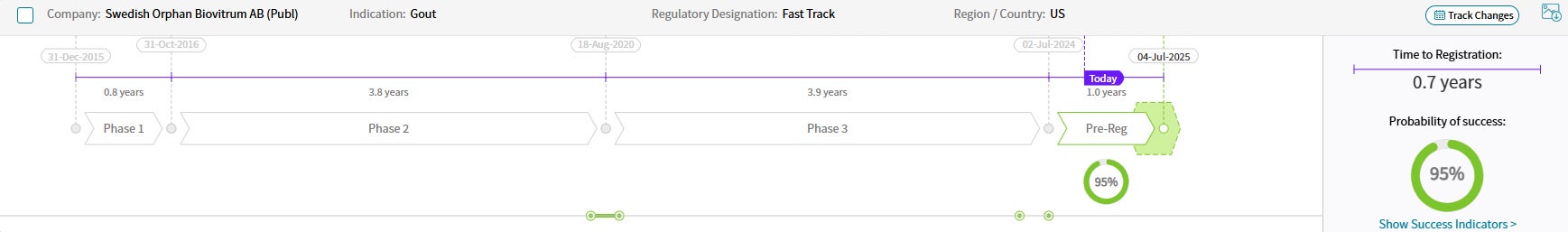
출처: Cortellis Competitive Intelligence, Drug Timeline & Success Rates Prediction, 2024년 10월 31일 기준
SEL-212가 통풍치료제 시장에 미칠 영향은?
-
주요 시장에서 급성 및 만성 통풍 치료제의 매출은 2023년 36억 달러에서 2033년 86억 달러로 증가할 전망입니다. 이는 주로 새 치료제의 출시 및 보급과 예측 기간에 통풍의 발생률 및 유병률 증가가 주된 원인입니다.
-
동시에, 개발 후기 단계에 있는 자산이 적고 통풍 환자 대부분을 효과적으로 치료하는 저렴한 제네릭 옵션이 있어 시장 가치가 제약을 받을 수도 있습니다. 제네릭 옵션이 낮은 가격과 만족스러운 효능, 의사에게 친숙함을 무기로 기본 치료제로서 지위를 유지할 가능성이 높습니다.
-
만성 통풍 시장만 보면, SEL-212는 KRYSTEXXA 대비 약 10%로 예상되는 프리미엄과 다른 치료제에 불응하는 만성 통풍 환자를 대상으로 하는 성공적 포지셔닝을 내세워 상당한 매출 성장이 기대됩니다.
-
SSEL-212는 효능과 안전성 프로필이 유사하고 투약 빈도가 낮으며 면역 조절제와 병용 투여가 가능하다는 점이 주요 경쟁 제품인 KRYSTEXXA 대비 강점입니다. KRYSTEXXA는 출시 후 첫 달에 5억 7백만 달러라는 매출을 달성했는데, 이것이 SEL-212의 가능성을 보여주는 지표가 될 만합니다.
SEL-212는 어떤 치료 공백을 메울 수 있는가?
미국에서 표준 치료에 반응하지 않는 만성 통풍 환자를 치료하는 약은 KRYSTEXXA뿐이지만 유럽과 일본에서는 KRYSTEXXA가 승인받지 못해 이 두 시장에서 만성 불응성 통풍 환자에게는 치료제가 없다시피 한 상황입니다. 치료 불응성 만성 통풍은 고통스럽고 환자를 쇠약하게 해 한 해에도 여러 차례 발작을 유발하고 결절성 요산 결정체(토피)를 만들기도 합니다. KRYSTEXXA가 출시된 시장에서는 SEL-212가 월 1회 주입과 두 가지 약물의 병용 투여가 가능하다는 점에서 환자와 의료진에게 환영받는 옵션이 될 것으로 기대됩니다. 이에 비해 KRYSTEXXA는 격주로 투여하고 Methotrexate와 함께 투여해야 합니다.
블록버스터 신약이 되기 위해 극복해야 하는 문제는?
SEL-212는 KRYSTEXXA와 경쟁할 잠재력이 있긴 하나, 만성 불응성 통풍 환자 인구가 상대적으로 적고(통풍 환자의 ~2%), 가격이 매우 높으며, 2030년에 KRYSTEXXA Pegloticase의 바이오시밀러 버전이 출시될 예정이어서 보급이 제한될 수도 있습니다.