mRESVIA
mRNA-1345
mRESVIA®는 2024년 5월 미국 FDA 승인을 받아 2024년 블록버스터 신약으로 선정된 AREXVY 및 ABRYSVO와 함께 60세 이상 성인에게 사용 가능한 호흡기 세포융합 바이러스(RSV) 백신으로서 RSV 관련 질병 부담을 줄여 주는 공중 보건 사업에 일조하고 있습니다. RVS 감염은 백신이 나와 있음에도 영유아와 고령자(65세 이상)를 중심으로 공중 보건에 대한 우려가 계속되고 있습니다.

mRESVIA® 소개
- Moderna Inc
- 안정화된 프리퓨전 F 당단백질을 코딩하는 mRNA 서열
- 60세 이상에서 RSV로 유발되는 하부 호흡기 질환(LRTD)을 예방해 주는 능동 면역으로 단회 접종, 0.5mL 근육 주사
- 2024년 G7 시장에서 진단 받은 RSV 입원 및 외래 환자 500만 명
블록버스터 신약 선정 이유
mRESVIA는 모더나의 COVID-19 백신과 동일한 지질 나노입자(LNP) 기술을 사용하며, 모더나의 mRNA 플랫폼을 기반으로 개발된 약물입니다. mRESVIA는 COVID-19 외 질병을 대상으로 한 최초의 mRNA 기반 RSV 백신이며, 일회용 프리필드 주사기로 투여하는 유일한 RSV 백신입니다.
이 백신은 AREXVY와 ABRYSVO을 포함하여 최근 RSV 백신 개발을 가속화한 획기적인 발견인 RSV F 단백질 기반 백신의 임상적 유효성을 입증한 사례입니다.
mRESVIA의 FDA 승인은 글로벌 3상 임상시험에서 수집된 긍정적인 데이터를 바탕으로 이뤄졌습니다.
-
22개국에서 60세 이상 성인 약 37,000명이 참여.
-
3.7개월의 추적 관찰 중앙값에서 RSV 관련 LRTD에 대한 백신 효능은 83.7%(95.88% CI 66.0%, 92.2%)였습니다.
-
중앙값 8.6개월 추적 관찰 데이터에 대한 추가 분석에서 RSV 관련 하부호흡기질환(LRTD)에 대한 지속적 백신 효능은 다음과 같았습니다.
-
두 증상에 대해서는 63.3%(95% CI: 48.7%, 73.7%).
-
숨가쁨을 포함해 증상이 둘 이상일 때 74.6%(95% CI, 50.7, 86.9).
-
증상이 셋 이상일 때 63.0%(95% CI, 37.3%, 78.2%).
-
가장 흔하게 보고된 부작용은 주사 부위 통증, 피로, 두통, 근육통, 관절통이었습니다.
미국에서 승인이 난 후 60세 이상 성인에게 백신을 사용하라는 CDC ACIP의 공식 권고가 있었습니다.
mRESVIA를 사용할 수 있는 인구를 확대하기 위한 시험이 다음과 같이 진행 중입니다.
-
18세 이상 60세 미만의 고위험군(파트 A)과 18세 이상 고형 장기 이식을 받은 환자(파트 B)를 대상으로 한 3상 연구
-
1회 근육 주사(파트 A)
-
T1일차 및 57일차 근육 주사 2회(파트 B)
-
완료 예정: 2026년 7월
-
2세~5세 미만(코호트 1, 3)과 5세~18세 RSV 고위험군(코호트 2) 소아를 대상으로 한 2상 임상 연구
-
1회 근육 주사(코호트 2) 대 위약(코호트 1 및 3)
-
완료 예정: 2025년 4월
-
18세 이상~40세 미만 임산부와 백신 접종 산모에게서 태어난 영아를 대상으로 한 2상 임상시험
-
임신 28주에서 36주 사이 1회 근육 주사
-
완료 예정: 2026년 2월
-
생후 5개월에서 24개월 미만 영아를 대상으로 한 1상 연구
-
1일, 57일, 113일에 1회 근육 주사
-
완료 예정: 2026년 7월
심사 및 승인 현황
2021년 8월
- 패스트 트랙 지정: 미국 FDA
2023년 1월
- 혁신 신약 지정: 미국 FDA
2024년 5월
- 승인: 미국 FDA
2024년 8월
- 승인: E.U.EMA
실제 및 예상 출시:
- 2024년: E.U.,미국
- 2025년: 일본,영국
특허 만료 예상시기: 2038년
약물 일정 및 성공 확률

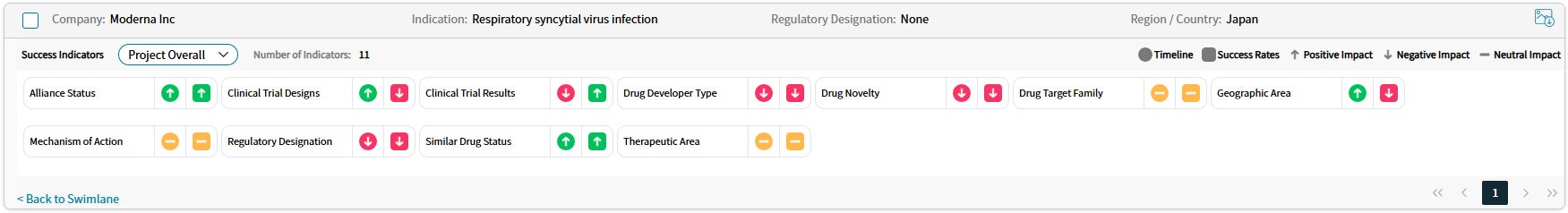
출처: Cortellis Competitive Intelligence, Drug Timeline & Success Rates Prediction, 2024년 10월 31일 기준
mRESVIA가 RSV 예방 시장에 미칠 영향은?
-
일반 백신 접종 인구(75세 이상 성인 및 산모 예방접종을 통해 아기를 보호하려는 임산부)를 대상으로 한 RSV 백신 및 예방 시장은 G7 국가에서 2033년까지 70억 달러에 달할 것으로 예상되며, 이에 따라 시장 환경은 점점 더 경쟁이 치열해질 것으로 예상됩니다.
-
2023년 보고서에서 블록버스터 신약으로 선정된 기존의 두 백신, ABRYSVO와 AREXVY는 서로 매우 다른 행보를 보이고 있습니다.
-
AREXVY는 미국, 캐나다, E.U., 일본에 최초로 진출했으며, 이후 E.U, 미국 및 일본에서 50세에서 59세의 고위험군을 대상으로 승인을 받았습니다. 미국 내 60세 이상 성인 60%가 RSV 백신을 접종했으며, 2023년 전 세계 총 매출은 12억 3,800만 파운드(16억 5,000만 달러)에 달할 것으로 전망됩니다. 실제로 AREXVY의 2023년 매출은 거의 다 미국에서 발생하다시피 했으며,3 현재 RSV 백신 시장 점유율 1위는 대부분 소매 약국과 맺은 계약 덕분입니다. 2024년에는 매출이 둔화되어 1분기에는 4억 3,200만 파운드(5억 5,570만 달러)에 그쳤습니다. 다만 2024~2025년 RSV 시즌이 시작되면 상황이 달라질 수도 있습니다.
-
ABRYSVO는 고령자(2023년 5월)와 임산부(2023년 8월)를 포함해 더 넓은 계층을 대상으로 출시되어 2024년 10월 18세~59세 고위험 성인(50세 미만 성인으로는 최초 승인)을 대상으로 승인을 받았으며, 2024년 11월에는 50세 미만의 성인에게도 승인을 받았습니다. 그러나 2023년 출시 이후 매출은 8억 9천만 달러로, 2023년 3분기 AREXVY 매출과 비슷한 수준에 그쳤습니다. 매출은 2024년 산모 예방접종에 기대를 걸었음에도 주로 미국 내 고령 인구에서 나왔습니다.6 인구 가 늘었음에도 2024년 1분기 매출은 3억 5,600만 달러로 감소했습니다.
-
다른 임상 개발 후보로는 다음과 같은 것들이 포함됩니다:
-
ADV-110 (Advaccine Biopharmaceuticals): RSV에 대한 재조합 단백질 백신
-
BLB-201 (Blue Lake Biotechnology 및 CyanVac LLC): RSV 재조합 바이러스 벡터 백신
-
CodaVax-RSV(Codagenix): cLive 약독화 바이러스 백신(RSV용)
-
D46/NS2/N/deltaM2-2-HindIll (NIAID): RSV 재조합 바이러스 벡터 백신
-
DS-Cav1 (NIAID): RSV에 대한 단백질 서브유닛 백신
-
IVX-A12 (Icosavax Inc/AstraZeneca): 인간 메타뉴모바이러스 및 RSV에 대한 바이러스 유사 입자 및 단백질 서브유닛 백신
-
mRNA-1045 (Moderna Inc): 인플루엔자 및 RSV에 대한 mRNA 백신
-
mRNA-1230 (Moderna Inc): SARS-CoV2, 인플루엔자 및 RSV에 대한 mRNA 백신
-
mRNA-2365 (Moderna Inc): RSV와 인간 메타뉴모바이러스(hMPV)에 대한 mRNA 백신
-
MV-012-968 (Meissa Vaccines): RSV에 대한 약독화 생백신
-
RSV 6120/deltaNS2/1030s(NIAID): RSV에 대한 cLive 약독화 바이러스 백신
-
RSV-276 (NIAID): RSV에 대한 약독화 바이러스 생백신
-
SP0125 (Sanofi): RSV에 대한 약독화 바이러스 생백신
-
V-306 (Virometix AG): RSV에 대한 합성 바이러스 유사 입자 백신
-
VVN-0200 (Daiichi Sankyo): RSV에 대한 VAGA-9001a 항원; MABH-9002b 면역증강제
-
VXB-241(Vicebio Ltd): 인간 파라인플루엔자 바이러스 3형(PIV3), hMPV, RSV을 대상으로 독자적 분자 클램프 기술을 이용하여 개발한 단백질 서브유닛 백신
-
VXB-251(Vicebio Ltd): 독자적 분자 클램프 기술을 이용하여 개발한 단백질 서브유닛 백신(hMPV 및 RSV용)
mRESVIA은 어떤 치료 공백을 메울 수 있는가?
RSV로 인한 중증 호흡기 질환으로 발생하는 계절성 입원은 특히 영유아, 소아, 고령자, COPD 및 천식과 같은 기저질환을 가진 사람들에게 지속적인 공중 보건 문제로 남아 있습니다. RSV 백신은 감염병 관리, 이환율 및 사망률 감소, 병원 부담 완화라는 문제 해결에 기여할 것으로 예상됩니다. 특히 RSV, 독감, COVID-19의 ‘삼중 유행’ 기간 동안 그 효과가 두드러질 것입니다.
블록버스터 신약이 되기 위해 극복해야 하는 문제는?
mRESVIA는 세 번째로 출시된 RSV 백신으로, ABRYSVO 및 AREXVY와 후기 단계의 RSV 백신들과 경쟁하게 됩니다. mRESVIA는 다른 RSV 백신과 달리 의료 전문가의 조제가 필요하지 않다는 장점이 있지만, 유통기한이 짧고 극저온 보관 조건이 요구되어 사용 범위가 제한될 가능성이 있습니다. 또한, 2024년 중반에 50~59세 연령층에 RSV 백신을 권장할지에 대한 CDC ACIP의 결정 지연이 판매에 영향을 미칠 수 있습니다. 더불어, 백신이 여러 해 동안 예방 효과를 유지할 수 있어 매년 접종이 필요 없다는 CDC의 제안도 mRESVIA의 판매에 영향을 미칠 수 있습니다.