IMDELLTRA
tarlatamab
IMDELLTRA™는 치료가 어려우며 예후가 좋지 않은 확장병기 소세포 폐암(ES-SCLC)을 대상으로 개발된 최초의 면역치료제입니다. 이 약물은 Amgen의 이중 특이적 T 세포 결합체(BiTE®) 분자를 활용한 융합 단백질로, 두 가지 표적인 T세포의 CD3와 암세포의 DLL3에 결합합니다. 이를 통해 T세포가 암세포를 인식하고 공격해 암세포를 용해시킬 수 있습니다.DLL3는 화학요법 치료 여부와 관계없이 85% 이상의 SCLC 환자에서 암세포 표면에 발현되며, 건강한 세포에서는 거의 발현되지 않아 이상적인 표적이 됩니다. IMDELLTRA는 이러한 독특한 작용 기전(MOA)을 통해 이전 치료를 받은 ES-SCLC 환자들에게 표준 치료제로 자리 잡을 가능성이 높습니다.

IMDELLTRA™ 개요
- Amgen
- DLL3 × CD3 표적 BiTE® 분자
- 백금 기반 화학요법 중에 또는 이후에 질병이 진행된 성인 ES-SCLC 환자에게 격주로 정맥주입하는 요법
- 신경내분비 전립선암을 비롯해 다른 암 적응증에 대해서도 평가 중
- 2024년에 G7 시장에서 재발성 또는 불응성(2차 이상) 확장병기 단계 SCLC 신규 환자 약 8만 1천 명 발생
블록버스터 신약 선정 이유
소세포 폐암(SCLC)은 통제되지 않은 세포 성장과 조기 전이가 특징인 공격적인 악성 종양입니다. 재발성 또는 불응성 SCLC에 대한 현재의 주된 치료법은 화학요법으로, 전체 생존(OS) 중앙값이 약 5개월에 불과하여 충족되지 않은 수요가 상당히 높습니다.
2상 DeLLphi-301 시험에서 IMDELLTRA는 뛰어난 효능을 보여 미국 FDA로부터 신속 승인을 받았습니다.
-
ORR: 40%
-
DOR 중앙값: 9.7개월
-
PFS 중앙값: 4.9개월(추적 관찰 기간 중앙값 10.6개월)
-
OS 중앙값: 14.3개월(추적 기간 중앙값 10.6개월)
DeLLphi-301 연구의 16.6개월 추적 관찰 데이터는 **2024년 세계폐암학회(WCLC)**에서 발표되었으며, 백금 기반 화학요법 중 또는 이후 질병이 진행된 재발성 또는 불응성 소세포 폐암(SCLC) 환자들을 대상으로 IMDELLTRA의 승인을 뒷받침하는 추가적인 증거를 제공했습니다.
-
OS 중앙값: 15.2개월(추적 기간 중앙값 20.7개월)
-
6개월 OS율: 73.4%
-
PFS 중앙값: 4.3개월
-
ORR: 40%
-
CR: 3%
-
PR: 37%
-
중앙값 DOR: 9.7개월
-
중앙값 DCR: 70%
-
복용량 감소로 이어지는 이상사례: 16%
-
치료 중단으로 이어지는 이상사례: 4%
-
CRS 3등급 이상: 4%%
추가 3상 시험은 확인과 라벨 확장을 목표로 하고 있습니다.
-
DeLLphi-304: 백금 기반 1차 화학요법 후 재발한 성인 2차 SCLC 환자(재발성 또는 불응성 SCLC에 대한 IMDELLTRA의 정규 승인을 위한 확인 임상시험)
-
IMDELLTRA와 표준 치료(Lurbinectin, Topotecan, Amrubicin) 비교
-
일차 평가변수: OS
-
예상 일차 및 연구 완료: 2027년 7월
-
DeLLphi-305: IMFINZI®(성분명: Durvalumab, AstraZeneca)+ 화학요법과 1차 유도 요법으로 치료받은 성인 ES-SCLC 1차 환자
-
IMFINZI 1차 유도 요법 및 화학 요법 후 1차 확장병기 단계 소세포폐암 치료
-
IMDELLTRA와 IMFINZI 병용 요법 vs. IMFINZI 단독 요법
-
일차 평가변수: OS
-
예상 일차 완료: 2027년 9월
-
예상 연구 완료: 2028년 9월
-
DeLLphi-306: 동시 항암화학방사선요법 후에도 진행되지 않은 성인 제한기 소세포폐암(LS-SCLC) 환자
-
IMDELLTRA vs.위약
-
일차 평가변수: PFS
-
예상 일차 및 연구 완료: 2029년 10월
심사 및 승인 현황
2023년 10월
혁신 신약 지정: 미국 FDA
2023년 12월
우선 심사: 미국 FDA
2024년 5월
가속 승인: 미국 FDA
실제 및 예상 출시:
- 2024년: 미국
- 2025년 E.U., 일본
- 2027년: 중국
특허 만료 예상시기: 2036년
약물 일정 및 성공 확률
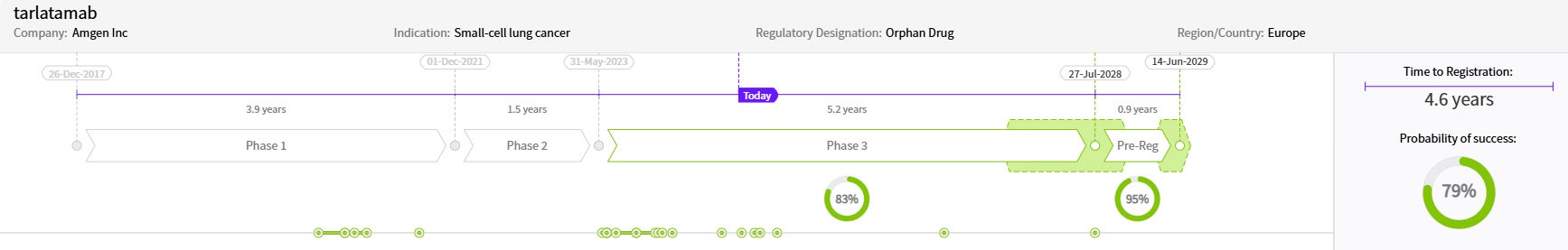

출처: Cortellis Competitive Intelligence, Drug Timeline & Success Rates Prediction, 2024년 10월 31일 기준
IMDELLTRA가 소세포폐암 치료제 시장에 미칠 영향은?
-
주요국의 SCLC 약물 치료 시장은 2022년 매출 17억 달러에서 2032년 58억 달러로 연평균 성장률 13%를 기록할 것으로 전망됩니다.
-
2022년부터 2032년까지 약물 치료가 가능한 인구 증가로 진단 증례가 늘어나고, 재발성 SCLC의 약물 치료율 상승이 시장 성장에 기여할 것으로 보입니다. 질병의 재발과 내성은 여전히 SCLC의 주요 특징으로 남아 있어, 2차 및 3차 치료의 약물 치료율이 각각 약 70%에서 76%, 48%에서 56%로 점진적으로 증가할 전망입니다.
-
재발성 또는 불응성 환자 집단은 SCLC 치료에서 상업적으로 가장 수익성이 높은 시장으로, 전체 약물 치료 기회의 절반 이상을 차지할 것으로 보이며, 이 추세는 2032년까지 지속될 전망입니다. IMDELLTRA는 2차 이상 치료에 대해 승인을 받았기 때문에 이 시장에서 상당한 매출을 올릴 가능성이 높습니다.
-
3차 환자 부문의 매출은 2022년 5,300만 달러에서 2032년 8억 1,700만 달러로 성장할 것으로 예상되며, IMDELLTRA와 Ifinatamab deruxtecan(Merck와 Daiichi Sankyo)이 후기 치료 라인의 매출에 크게 기여할 것으로 보입니다.
-
IMDELLTRA와 Ifinatamab deruxtecan은 후기 치료 환경에서 효과적인 치료제에 대한 수요를 충족시키고 치료 옵션의 다양성을 확대할 수 있지만, 높은 비용과 복잡한 독성 관리로 인해 기존 화학 요법과 경쟁하기는 어려울 수 있습니다.
-
SCLC는 백금 기반 화학 요법에 매우 민감하며, 제한단계 소세포폐암(LS-SCLC)과 ES-SCLC 모두에서 전신 화학 요법이 기본 치료로 권장됩니다. 그러나 IMDELLTRA와 같은 혁신적인 신약은 현재 표준 치료에 추가 요법으로 자리잡을 가능성이 높아 빠르게 보급될 것으로 예상됩니다.
IMDELLTRA은 어떤 치료 공백을 메울 수 있는가?
SCLC는 치료 옵션이 제한적인 공격적인 암입니다. 2차 치료 옵션의 반응 기간은 일반적으로 3.6개월에서 5.3개월에 불과하며, 전체 생존 기간(OS)은 8개월 미만입니다. 비소세포폐암(NSCLC)에서는 치료 목표가 완치에 초점을 맞추는 반면, ES-SCLC는 연명, 질병 진행 지연, 증상 완화가 주요 목표입니다. ES-SCLC는 화학 요법에 매우 민감하지만, 내성 발생이 불가피하고, 후기 치료로 혜택을 받는 환자는 거의 없으며, 다수의 환자가 심각한 부작용과 삶의 질 저하를 경험합니다.1차 ES-SCLC에서 면역 요법 사용이 증가하면서 2차 이상 환경에서는 면역 요법 사용이 제한되었습니다. LS-SCLC와 ES-SCLC의 OS를 연장하고, 2차 및 3차 치료 환경의 공백을 메우는 치료 옵션이 절실한 상황에서 IMDELLTRA는 이를 해결할 잠재력을 가지고 있습니다.
블록버스터 신약이 되기 위해 극복해야 하는 문제는?
독성 및 심각한 부작용은 동반 질환이 많거나 질병 자체로 인한 장애를 가진 환자에게 적합하지 않은 경우가 많습니다. IMDELLTRA는 프리미엄 가격(환자당 약 150,500달러)에 의해 표준 화학 요법 및 세포독성 약물과 경쟁하기 어려울 수 있습니다. IMDELLTRA의 까다로운 안전성 프로필, 특히 사이토카인 방출 증후군(CRS) 및 면역효과성 신경독성 증후군(ICANS)에 대한 박스형 경고는 의사들이 처방을 꺼리는 요인이 될 가능성이 있습니다. IMDELLTRA의 잠재적 경쟁 약물로는 DLL3 × CD3 이중 특이적 항체 BI-764532(Boehringer Ingelheim), DLL3/CD3/CD137 삼중 특이적 항체 MK-6070(Merck) 및 RG6524(Roche)가 있습니다.질병이 빠르게 진행되고 생존 기간이 짧은 특성 때문에, IMDELLTRA가 후기 요법에서 주로 사용될 경우 매출이 제한될 수 있습니다.