Fitusiran
Fitusiran은 항체 유무와 관계없이 혈우병 A형과 B형 모두에서 3상 임상시험을 통해 효능이 입증되었으며, 모든 혈우병 환자에게 혁신적인 치료제가 될 가능성을 갖추고 있습니다. Fitusiran은 짧은 간섭 RNA(siRNA) 치료제로, SerpinPC1 mRNA를 억제 및 분해하여 항트롬빈 수치를 낮추고, 트롬빈 생성을 촉진하며, 이를 통해 지혈 균형을 재조정하고 출혈을 예방합니다. Fitusiran은 Alnylam® Pharmaceutical Inc의 ESC-GalNAc 접합 기술을 활용하며, 승인 일정에 따라 이중 가닥 RNA 분자를 기반으로 한 최초의 항트롬빈 저하 치료제가 될 수도 있습니다.

Fitusiran 소개
- Alnylam Pharmaceuticals Inc 및 Sanofi
- 항트롬빈 표적 siRNA
- 항체 유무와 관계없이 혈우병 A형 또는 B형의 예방 치료를 위해 월 1회 또는 격월로 피하 투여
- 2023년 G7 시장에서 혈우병 A형 진단 유병 증례 ~4만 5천 건
- 2023년 G7 시장에서 혈우병 B형 진단 유병 증례 ~1만 1천 건
블록버스터 신약 선정 이유
3상 임상시험 데이터에 따르면, Fitusiran을 예방 치료제로 사용했을 때 온디맨드 인자 농축액 대비 연간 출혈률(ABR)이 유의미하게 감소했으며, 참가자 중 약 절반에서 출혈이 발생하지 않았습니다. 또한 항체 유무와 관계없이 혈우병 A형 및 B형 환자에서 큰 수술을 안전하게 수행할 수 있는 잠재력을 보였습니다. 2020년 말 안전성 문제로 인해 중단되었던 임상시험이 2021년에 재개되면서, 항트롬빈 기반 투여 요법(AT-DR)을 적용한 연구를 통해 추가적인 안전성 데이터를 확보했습니다. AT-DR은 혈전 발생 위험을 감소시키고 간 효소 수치 상승, 담낭 염증, 담석 발생을 줄이는 것으로 나타났습니다.
Fitusiran의 효능과 안전성은 ATLAS 임상 개발 프로그램을 통해 평가되었으며, 다음 3상 연구 결과에서 확인되었습니다.
-
ATLAS-A/B 연구: 억제제가 없는 혈우병 A형 또는 B형 환자 120명(만 12세 이상)을 대상으로 진행
-
9개월 동안 월 1회 SC Fitusiran 예방 투여와 온디맨드 응고인자 농축액 투여 비교
-
Fitusiran으로 치료받은 환자군에서 ABR 89.9% 감소
-
ABR 중앙값: 0.0(Fitusiran) vs 21.8(온디맨드 응고인자 농축액)
-
출혈 치료가 없는 환자 비율: 50.6%(Fitusiran) vs 5.0%(온디맨드 응고인자 농축액)
-
TEAE로 보고된 항목: ALT 또는 AST 상승(정상 상한치의 3배 이상), Fitusiran 그룹 중 19%에서 보고
-
ATLAS-INH 연구: 억제제가 있는 혈우병 A형 또는 B형 환자 60명(만 12세 이상)을 대상
-
9개월 동안 월 1회 SC Fitusiran 예방 투여와 온디맨드 우회 제제 비교
-
치료받은 ABR 90.8% 감소 (Fitusiran 투여군)
-
ABR 중앙값: 0.0(Fitusiran) vs 16.8(온디맨드 우회 제제)
-
출혈이벤트 없는 환자: Fitusiran으로 치료받은 환자 25명(65.8%)
-
TEAE로 보고된 항목: ALT 또는 AST 상승(정상 상한치의 3배 이상), 혈전색전증 의심 또는 확진 사례, Fitusiran 투여군에서 10명(24.4%)에서 발생
-
ATLAS-PPX 연구: 인자 농축액 또는 우회 제제를 사용해 예방 치료를 받은 적이 있는 중증 혈우병 A형 또는 B형 환자 80명(만 12세 이상, 억제제 유무와 무관)을 대상
-
O7개월 동안 월 1회 SC Fitusiran 예방 투여 (이전 치료법을 비교군으로 설정)
-
모든 출혈에 대한 ABR: 2.9(Fitusiran) vs 7.5(이전 응고인자 농축액 또는 우회 제제 예방요법)
-
자연 출혈 ABR: 2.2(Fitusiran) vs 5.0(이전 응고인자 농축액 또는 우회 제제 예방요법)
-
출혈 이벤트가 없는 환자: 44명(67.7%, Fitusiran투여) vs 22명(33.8%, 이전 응고인자 농축제제 또는 우회제제 예방요법 시행)
-
SAE발생: 9명(13.4%, Fitusiran) vs 5명(7.7%, 이전 응고인자 농축제제 또는 우회제제 예방요법시행)
진행 중인 시험:
-
ATLAS-OLE: ATLAS-A/B, ATLAS-INH, ATLAS-PPX 대상 오픈 라벨 확장 연구
-
항체 유무와 관계없이 중증 A형 또는 B형 혈우병 환자 281명(만 12세 이상)
-
AT-DR을 이용하여 월 1회 또는 격월 예방적 SC Fitusiran 투여. AT-DR은 최장 48개월 동안 항트롬빈 목표 범위를 15%-35%(더 낮은 용량, 더 적은 빈도로 투여)로 유지하도록 설계
-
일차 평가변수: TEAE를 겪은 참가자의 수
-
이차 평가변수: ABR + 3
-
완료 예정: 2026년 11월
-
3상 ATLAS-PEDS: 용량 결정 연구
-
항체 유무와 관계없이 중증 A형 또는 B형 혈우병 아동 32명(1세~12세)
-
256주 동안 SC Fitusiran 투여
-
일차 평가변수: 혈장 항트롬빈 활성도
-
완료 예정: 2028년 8월
-
3상 ATLAS-NEO
-
항체 유무와 관계없이 전에 SOC 치료를 받은 적이 있는 중증 A형 또는 B형 혈우병 남성 75명(만 12세 이상)
-
6개월간 SOC(응고인자 농축액 또는 우회제제, 항트롬빈 농축액[ATIIIC]), 36개월간 AT-DR을 이용한 SC Fitusiran, 6개월간 안티트롬빈 추적 관찰
-
일차 평가변수: ABR
-
완료 예정: 2028년 3월
심사 및 승인 현황
2014년 7월
희귀의약품 지정: E.U. EMA(혈우병 A형)
2021년 2월
패스트 트랙 지정 승인: 미국 FDA
2023년 12월
혁신 신약 지정(항체가 있는 혈우병 B형): 미국 FDA
2024년 5월
MAH 제출: 중국 NMPA
2024년 6월
NDA 승인: 미국 FDA
2025년 3월 28일
PDUFA 날짜
실제 및 예상 출시:
- 2025년: E.U.,일본, 중국, 영국, 미국
특허 만료 예상시기: 2022년
약물 일정과 성공 확률
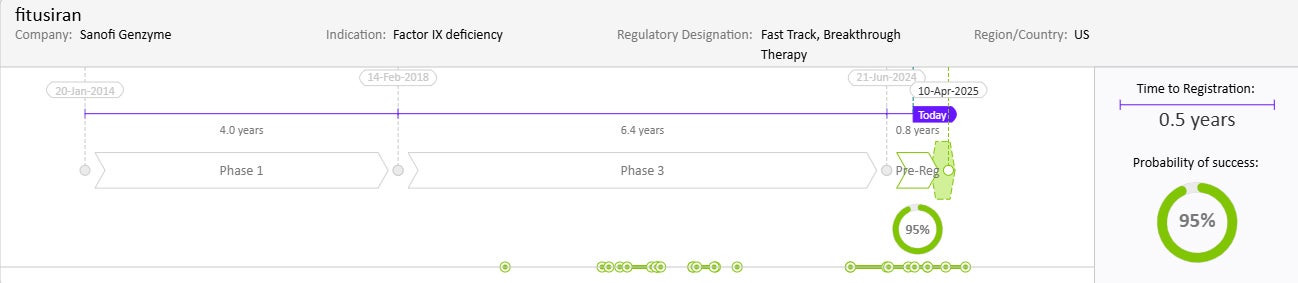
출처: Cortellis Competitive Intelligence, Drug Timeline & Success Rates Prediction, 2024년 10월 31일 기준
Ftusiran이 혈우병 A형 및 B형 치료제 시장에 미칠 영향은?
-
향후 4~5년 내에 다양한 비인자 및 유전자 치료제가 출시되면 혈우병 B형의 치료 패러다임이 크게 변화할 것으로 보이며, 의료진은 혈우병 환자들에게 효과적이고 편리한 여러 옵션을 제공할 수 있을 것으로 전망됩니다.
-
Fitusiran, Alhemo™ (concizumab, Novo Nordisk), HYMPAVZI™ (marstacimab, Pfizer Inc)과 같은 혈액 응고 재균형 비인자 치료제는 항체가 없는 혈우병 B형 환자에게 응고인자 농축액보다 더 편리한 대안이 될 수 있습니다. 그러나 반감기 연장 FIX 요법도 유사한 효능과 안전성을 제공하며 투약 부담이 적기 때문에 이미 잘 관리되고 있는 환자들에게는 적합한 치료법으로 평가될 수 있습니다. A형 혈우병 환자들은 HEMLIBRA®(emicizumab; Roche 그룹의 Genentech 및 Chugai Pharmaceutical Co Ltd)와 ALTUVOCT®/ALTUVIIIO®(Sobi®와 Sanofi)를 통해 주 1회 비인자 또는 응고인자 치료를 선택할 수 있습니다. 이로 인해, 명확한 효능 또는 안전성의 이점이 없는 새 치료제가 기존 치료제를 넘어설 가능성은 낮아 보입니다.
-
SC 투여 방식과 Fitusiran 및 HYMPAVZI의 낮은 투약 빈도가 결합되면 환자들 사이에서 치료 전환이 발생할 가능성이 있습니다. 이는 약물 치료율이 이미 높고 이를 더욱 증가시키기 위한 여지가 제한적인 시장 점유율에 중요한 요인입니다. 전반적으로 시장은 향후 10년 동안 매우 느리게 성장할 것으로 예상됩니다.
-
환자들이 HEMGENIX®(etranacogene dezaparvovec, CSL Behring), BEQVEZ™(fidanacogene elaparvovec, Pfizer Inc)과 같은 더 편리하고 저렴하며 유사한 안전성을 가진 비인자 및 유전자 치료제로 전환하면서, NovoSeven®(Novo Nordisk), FEIBA(Takeda), SEVENFACT®(HEMA Biologics)와 같은 주사부담이 높고 출혈에 대해 효능이 낮은 온디맨드 우회 요법의 사용은 줄어들 가능성이 높습니다.
-
Fitusiran은 항체 유무와 관계없이 혈우병 A형 및 B형 환자 모두에게 상당한 영향을 미칠 것으로 보입니다.
-
가장 큰 영향을 받는 집단은 항체가 있는 혈우병 B형 환자가 될 가능성이 높습니다.
-
A형 혈우병의 경우, KOL에 따르면 Fitusiran의 위험-편익 프로필과 월/격월 투여 스케줄이 HEMLIBRA의 주 1회 투여보다 유리할 수 있습니다. 이는 월 1회 투여가 임상적으로 덜 효과적일 수 있다는 점도 시사합니다.
Fitusiran이 메울 수 있는 치료 공백
혈우병 A형과 B형 치료의 주요 목표는 출혈, 특히 영구적 관절 손상과 관련된 관절 출혈을 예방하는 것입니다. 또한, 삶의 질 향상도 중요한 결과로 간주됩니다. 그러나 현재의 FVIII 및 FIX 대체 요법은 정맥주사 투여 경로와 주 1~2회 투여 빈도로 인해 환자들에게 큰 부담이 됩니다. 이는 감염 및 혈전증 위험을 높이고, 최적의 치료 순응도를 저하시킬 수 있습니다. Fitusiran은 월 1회 또는 격월 피하주사를 통해 치료 부담을 줄이고 순응도를 높일 수 있습니다. 또한, 대체 요법을 받은 환자 중 약 20~30%는 시간이 지나면 항체가 형성될 가능성이 있지만, 이에 대한 치료 옵션은 제한적입니다. Fitusiran은 이러한 치료 공백을 효과적으로 메울 수 있는 잠재력을 갖추고 있습니다.
블록버스터 신약이 되기 위해 극복해야 하는 문제는?
Fitusiran이 겨냥하는 시장은 환자 수가 적고, 환자 및 의료진 모두에게 이미 잘 정립된 예방 및 온디맨드 치료 옵션이 익숙하며, 경쟁이 치열한 분야입니다. A형 혈우병 치료에서는 ALTUVOCT/ALTUVIIIO, Elocta®/Eloctate®(Sobi와 Sanofi), ADYNOVATE®(Takeda)와 같은 약물이 이미 표준 반감기 및 반감기 연장 요법보다 편리한 투약 스케줄을 제공하고 있습니다. 따라서 기존 치료로 관리 중인 환자들이 새 치료제로 전환할 동기가 크지 않을 수 있습니다. 비항체 집단에서는 많은 환자가 응고인자 농축액으로 잘 관리되고 있어 새 비인자 치료제가 큰 영향을 미치기 어려울 수 있습니다. 또한, 혈전 발생과 같은 안전성 문제에 대해 의료진이 우려하는 상황에서는 충분한 실제 데이터가 확보되기 전까지 Fitusiran의 초기 채택이 제한될 가능성도 있습니다.