EBGLYSS
lebrikizumab
EBGLYSS는 DUPIXENT®(Dupilumab, Sanofi 및 Regeneron Pharmaceuticals Inc)와 ADBRY®/ADTRALZA®(Tralokinumab, LEO Pharma)에 이어 아토피 피부염 치료제로 IL-13을 표적으로 하는 생물학적 제제 중 세 번째로 출시된 약물입니다. 하지만 EBGLYSS는 투여 빈도가 낮고, IL-13 억제가 선택적이며, 효능과 안전성 데이터가 풍부하다는 점에서 국소 코르티코스테로이드(TCS) 처방만으로는 충분하지 않은 중등도에서 중증 아토피 피부염 환자의 1차 치료제로 사용될 가능성이 있습니다.

EBGLYSS™ 개요
- Eli Lily 및 Almirall
- IL-13 표적 mAb
- 성인과 체중이 88파운드(40kg) 이상인 12세 이상 어린이의 중등도-중증 아토피 피부염을 치료하는 피하 주사제
- 적절한 임상 반응이 나타날 때까지 (16주차부터) 2주마다 투여한 후, 유지 관리를 위해 매월 투여
- 2023년 G7 시장에서 아토피 피부염 유병 증례 ~7,050만 건
- 아토피 피부염 사례의 ~40%는 중등도에서 중증
블록버스터 신약 선정 이유
Eli Lilly는 2020년 Dermira를 11억 달러에 인수하면서 EBGLYSS를 면역학 중심의 파이프라인에 추가했습니다. EBGLYSS는 유럽 시장에서 Almirall에 사용권이 부여되었으며, 현재 생후 6개월 미만의 소아를 대상으로 한 임상시험도 진행 중입니다. 이를 통해 EBGLYSS는 기존 아토피 피부염 치료제와의 경쟁에서 더 강력한 입지를 다질 것으로 보입니다.
EBGLYSS는 TCS와 병용하거나 단독으로 사용할 수 있으며, 치료 초기부터 임상반응이 충분히 나타나는 16주까지 2주마다 1번씩 250mg주사 한 후, 이후에는 월 1회 유지 주사로 투여합니다. EBGLYSS는 IL-13Rα1/IL-4Rα 이합체 복합체의 형성을 방해한다는 점에서 기존 IL-13 표적 치료제와 차별화됩니다.
EBGLYSS의 승인은 세 차례의 글로벌 3상 임상시험에서 얻은 긍정적인 데이터를 바탕으로 이루어졌습니다.
-
ADvocate 1과 ADvocate 2: 성인과 소아(12세 이상 18세 미만, 체중 40kg 이상) 중등도-중증 습진 환자
-
52주 무작위 배정, 이중 맹검, 위약 대조, 병렬 그룹 연구
-
EBGLYSS 단독 요법(16주 치료 유도 기간): 초기 및 2주마다 500mg, 유지 기간: 2주마다 250mg 또는 위약)
-
16주째에 38%, 4주째에 10%가 연구자 글로벌 평가(IGA) 0 또는 1에 도달(위약은 12%)
-
응답자의 77%는 월 1회 투여로 1년 후에도 결과를 유지
-
16주째에 위약으로 전환한 응답자의 48%가 1년 후에도 그 결과를 유지
-
16주 후 가려움증 수치 평가 척도(PNRS)로 측정한 결과 43%가 가려움증 완화를 경험(위약은 12%)
-
가려움증 응답자의 85%가 한 달에 한 번 복용 후 1년이 지난 후에도 효과를 유지
-
16주째에 위약으로 전환한 가려움증 응답자 중 66%가 1년 후에도 그 결과를 유지
-
ADhere: 중등도에서 중증의 습진이 있고 기준치에서 국소 약물로 증상이 적절히 조절되지 않는 성인과 소아(12세 이상 18세 미만, 체중 40kg 이상)
-
16주 무작위 배정, 이중 맹검, 위약 대조, 병렬 그룹
-
EEBGLYSS를 TCS와 병용 투여(초기 및 2주 간격으로 500mg, 유지 기간: 2주마다 250mg 또는 위약) 대 TCS와 위약 병용 투여
-
41.2%가 IGA 0 또는 1에 도달한 반면 위약 + TCS는 22.1%에 그침
-
69.5%가 습진 면적과 중증도 지수(EASI-75)에서 75% 개선(EBGLYSS + TCS 사용 시 75%, 위약 + TCS 사용 시 42.2%)
다른 3상 시험의 결과는 다음과 같으며 향후 적응증 추가에 기여할 것으로 예상됩니다.
-
ADore: 중등도에서 중증의 AD를 앓고 있으며 체중이 40kg 이상인 청소년(12세 이상~18세 미만)을 대상으로 한 글로벌 오픈 라벨 연구
-
52주 동안 단독 요법(2주 간격으로 2회 투여, 이후 4주부터 52주까지 2주마다 투여)으로 EBGLYSS를 투여
-
일차 평가변수: 마지막 치료 방문 시까지 부작용으로 인해 시험 치료를 중단한 환자의 비중
-
2.4%는 AE로 인해 치료를 중단했고, 2.4%는 SAE로 인해 치료를 중단했습니다.
-
65%가 한 가지 이상 TEAE를 경험했으며, 대부분 경증 또는 중등도의 중증도를 보였습니다.
-
62.6%가 기준치 대비 2% 포인트 이상 개선된 IGA 0 또는 1을 실현했습니다
-
81.9%가 EASI-75 달성
-
EASI 평균 개선율 86.0%
-
ADmirable: 미국에서 중등도-중증의 아토피 피부염을 앓고 있고 백인 외 인종이라고 스스로 밝힌 성인과 어린이(12세 이상)를 대상으로 한 오픈 라벨 연구
-
24주 동안 단독 요법(2주 간격으로 2회 투여, 이후 16주부터 24주까지 4주마다 투여)으로 EBGLYSS를 투여
-
완료 예정: 2024년 12월
-
ADapt: 미국에서 중등도-중증의 아토피 피부염을 앓고 있고 전에 DUPIXENT로 치료받은 적이 있으며 국소 약물로 충분히 통제되지 않는 성인과 어린이(12세 이상)를 대상으로 한 오픈 라벨 연구
-
24주 동안 단독 요법(2주 간격으로 2회 투여, 이후 16주부터 24주까지 4주마다 투여)으로 EBGLYSS를 투여
-
완료 예정: 2024년 12월
-
ADhope: 독일, 네덜란드, 스페인, 영국에서 국소 치료제에 실패한 중등도-중증 아토피 피부염 성인과 소아(12세 이상)를 대상으로 한 오픈 라벨 연구
-
단독 요법(2주 간격으로 2회 투여, 이후 16주부터 24주까지 4주마다 투여)으로 EBGLYSS 투여)
-
완료 예정: 2025년 5월
-
ADjoin: 이전 임상시험에서 EBGLYSS를 투여받고 모 임상시험의 연구 치료와 마지막 환자 방문을 제대로 완료한 성인 및 소아(12세 이상)를 대상으로 한 장기 글로벌 연장 임상시험
-
단독 요법으로 EBGLYSS 투여(100주 동안 2주 또는 4주마다)
-
완료 예정: 2025년 4월
-
ADlong: 독일과 폴란드에서 ADjoin에서 EBGLYSS로 치료를 완료하고 해당 연구의 마지막 참여자 평가 방문(100주차)을 마친 성인 및 소아(12세 이상)를 대상으로 한 장기 연장 연구
-
단독 요법 EBGLYSS 투여(104주 동안 4주마다)
-
완료 예정: 2026년 4월
-
ADorable-1: 중등도-중증 아토피 피부염을 앓고 있는 어린이(6개월~18세 미만)를 대상으로 한 글로벌 RCT
-
TCS와 결합된 EBGLYSS
-
완료 예정: 2025년 9월
-
ADorable-2: 중등도에서 중증의 아토피 피부염을 앓고 있고 ADorable 1 연구의 방문을 모두 제대로 마친 어린이(6개월~18세 미만)를 대상으로 한 장기 글로벌 연장 연구
-
TCS와 EBGLYSS 병용
-
완료 예정: 2026년 6월
심사 및 승인 현황
2012년 12월
패스트 트랙 지정: 미국 FDA
2023년 10월
CRL: 미국 FDA
2023년 11월
승인: E.U. EMA
2023년 12월
승인: 영국 MHRA
2024년 1월
승인: 일본 MHLW
2024년 9월
승인: 미국 FDA
실제 및 예상 출시:
- 2023년: E.U., 영국
- 2024년: 일본, 미국
- 2028년: 중국
특허 만료 예상시기: 2024년
약물 일정과 성공 확률
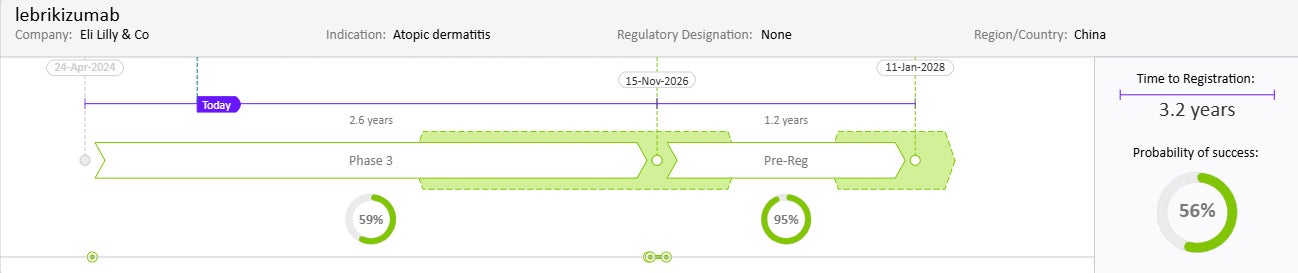
출처: Cortellis Competitive Intelligence, Drug Timeline & Success Rates Prediction, 2024년 10월 31일 기준
EBGLYSS가 아토피 피부염 치료제 시장에 미칠 영향은?
-
TCS는 입증된 효능, 낮은 비용, 관리 가능한 부작용 프로필, 그리고 임상의의 높은 친숙도를 바탕으로 아토피 피부염 치료의 주요 기반으로 자리 잡고 있습니다. 그러나 TCS보다 더 효과적인 전신 요법에 대한 필요성이 꾸준히 제기되고 있습니다.
-
2020년 이후 여덟 가지 치료 옵션이 출시되었으며, 향후 5년 동안 더 많은 치료법이 출시될 예정입니다. 이로 인해 약물 치료 인구가 유의미하게 증가할 것으로 전망됩니다. 중등도에서 중증 아토피 피부염 환자를 위한 새로운 치료법은 시장 성장을 주도할 가능성이 큽니다.
-
현재 생물학적 제제 시장은 DUPIXENT이 주도하고 있습니다. DUPIXENT은 2017년 처음 승인을 받았고, 2022년에는 생후 6개월 미만의 소아까지 사용 허가가 확대되었습니다. 임상시험 결과를 뒷받침하는 실제 데이터와 높은 의사 친숙도를 고려할 때, DUPIXENT의 시장 지배력은 당분간 유지될 것으로 보입니다.
-
그러나 EBGLYSS와 같은 생물학적 제제가 추가로 도입되면, 치료 패러다임이 생물학적 제제 중심으로 바뀌고 전체 생물학적 제제의 시장 점유율이 상승할 가능성이 큽니다. 이 중 IL-13을 표적으로 하는 치료제가 매출을 주도할 것으로 예상됩니다.
-
EBGLYSS의 내약성이 지속적으로 개선되고, 투약이 더욱 편리해지면 시장 점유율도 증가할 가능성이 있습니다.
-
일부 국가와 지역에서는 CIBINQO® (Pfizer Inc), OLUMIANT® (Eli Lilly and Co), RINVOQ® (AbbVie)와 같은 경구용 JAK 억제제가 효과적인 경구 치료 옵션으로 자리 잡고 있습니다. 이 치료제들은 높은 효과를 바탕으로 상당한 수익을 창출할 가능성이 있지만, 실제 안전 데이터가 추가로 확보되기 전까지는 생물학적 제제 이후 옵션으로 주로 사용될 전망입니다.
-
이 치료제들은 표적형으로 고가이지만 효과와 안전성이 우수해 저렴한 국소 및 전신 치료제를 일부 대체할 가능성이 있습니다.
EBGLYSS는 어떤 치료 공백을 메울 수 있는가?
중등도~중증 아토피 피부염 환자들은 현재 치료 옵션이 여러 가지 있음에도 불구하고 질병을 장기간 조절하지 못하거나 내성이 생기는 문제로 어려움을 겪고 있습니다. 심한 가려움증은 일상생활에 큰 지장을 초래하며, 이로 인해 정신 건강 장애, 사회적 낙인, 수면의 질 저하, 업무 및 학업 차질 등의 문제가 발생할 수 있습니다. 또한, 피부 장벽 기능 약화로 인해 긁는 행위가 바이러스성, 세균성, 곰팡이성 피부 감염으로 이어질 위험이 높아지며, 인두염, 귀 감염, 요로 감염(UTI) 등의 질환 발생 가능성도 커집니다. 보습제를 비롯한 다른 치료 요법으로 이러한 위험을 줄일 수 있지만, 꾸준히 사용해야 한다는 번거로움과 지속적인 피부 관리의 부담이 따릅니다. DUPIXENT와 ADBRY/ADTRALZA는 주사 빈도가 부담스러워 일부 환자와 간병인에게 투여가 어려운 경우도 있습니다. 중등도~중증 아토피 피부염 환자 중 기존 국소 치료제로 관리되지 않거나 DUPIXENT와 같은 최신 치료제에 반응이 불충분한 환자들에게는 더 편리하고, 효과적이며, 안전한 비스테로이드성 국소 또는 전신 치료제가 필요합니다. EBGLYSS는 월 1회 투여로 편리성을 제공하며, DUPIXENT에 비해 결막염 위험이 낮다는 점에서 차별화된 장점을 갖추고 있습니다.
블록버스터 신약이 되기 위해 극복해야 하는 문제는?
EBGLYSS는 세 번째로 출시된 IL-13 표적 치료제라는 점과 현재 사용 가능한 경구용 JAK 억제제와의 경쟁으로 인해 도입이 제한될 수 있습니다. 또한, 많은 아토피 피부염 환자들이 일반 의약품(OTC)이나 제네릭 치료제로 충분히 치료를 받고 있습니다. 또한, 많은 의료진은 재발성 발진이 있는 2회 사용하는 중등도에서 고효능 TCS 제네릭 약물을 처방하는 것을 선호합니다. 이러한 요인들은 고가의 표적 치료제를 사용하는 환자 수를 제한할 수 있습니다. 또한, EBGLYSS와 같은 고가의 생물학적 치료제는 보험 급여와 관련된 문제에 직면할 가능성도 있습니다.