mRESVIA
mRNA-1345
Drugs to Watch 2024で取り上げたAREXVYおよびABRYSVO(呼吸器合胞体ウイルス(RSV)ワクチンとして現在60歳以上の成人に使用)に続いて、2024年5月にmRESVIA®が米国FDAの承認を取得したことによって、RSV関連の疾患負荷を軽減する公衆衛生イニシアチブがさらに強化されています。ワクチンが利用可能となった今も、RSV感染症は特に乳幼児および高齢者(65歳以上)における公衆衛生上の懸念事項となっています。

mRESVIA® 一覧
- Moderna Inc
- 融合前立体構造で安定化Fタンパク質をコードするmRNA
- 呼吸器合胞体ウイルス(RSV)による下気道疾患(LRTD)予防を目的とする能動免疫化のための、60歳以上の高齢者への0.5 mL単回筋肉内注射
- 約500万人が、2024年にG7市場でRSVで入院または外来診断
なぜDrug to Watchなのか?
mRESVIAは、Moderna IncのmRNAプラットフォームの基礎開発に基づき開発されたワクチンであり、同社のCOVID-19ワクチンと同じ脂質ナノ粒子(LNP)を使用して製造されています。mRESVIAは初めてのmRNAベースのRSVワクチンであり、mRNAワクチンとしてはCOVID-19以外の疾患に対して初めて承認され、RSVワクチンとしては単回投与プレフィルドシリンジで使用可能な唯一のワクチンとなっています。
AREXVYおよびABRYSVOを含むRSVに対する近年のワクチン開発を加速させた画期的な発見であるRSV Fタンパク質に基づくワクチンの臨床的有効性が、このワクチンによってさらに裏付けられることとなります。
mRESVIAは、国際共同第3相臨床試験であるConquerRSV試験の良好なデータに基づいて承認されています。
-
被験者には22カ国の60歳以上の成人約37,000人が含まれます。
-
RSV関連LRTDに対するワクチンの有効性は、中央値3.7カ月の追跡期間において83.7%(95% CI: 66.0%, 92.2%)でした。.
-
中央値8.6カ月の追跡期間データの補足解析から得られた、RSV関連LRTDに対するワクチンの持続的な有効性は以下の通りです。
-
2つの症状に関して63.3% (95% CI: 48.7%, 73.7%)。
-
息切れを含む2つ以上の症状に関して、74.6%(95% CI: 50.7, 86.9)。
-
3つ以上の症状に関して、63.0%(95% CI: 37.3%, 78.2%)。
-
最も多く報告された有害事象は、注射部位疼痛、疲労、頭痛、筋肉痛および関節痛でした。
米国での承認後、CDC ACIPは60歳以上の成人へのワクチン接種を公式推奨しました。
mRESVIAの対象集団を拡大するための以下の試験が進行中です。
-
18歳以上60歳未満の高リスク患者(パートA)および18歳以上の固形臓器移植患者(パートB)を対象とした第3相試験
-
単回筋肉内投与(パートA)
-
Day 1およびDay 57の2回の筋肉内注射(パートB)
-
完了予定:2026年7月
-
2歳以上5歳未満の小児(コホート1およびコホート3)およびRSV罹患リスクの高い5歳~18歳の小児(コホート2)を対象とした第2相試験)
-
単回筋肉内注射(コホート2) vs. プラセボ(コホート1および3)
-
完了予定:2025年4月
-
18歳以上40歳未満の妊婦およびワクチン接種を受けた母親から産まれた乳児を対象とした第2相試験s
-
妊娠28週~36週に単回筋肉内注射
-
完了予定:2026年2月
-
生後5カ月~24カ月未満の乳児を対象とした第1相試験
-
1日目、57日目および113日目における単回筋肉内注射
-
完了予定:2026年7月
審査・承認状況
2021年8月
- ファストトラック指定:米国FDA
2023年1月
- ブレイクスルーセラピー指定:米国FDA
2024年5月
- 承認:米国FDA
2024年8月
- 承認:EU EMA
上市年(実績、予測)
- 2024年:EU、米国
- 2025年:日本、英国
2038年に特許存続期間が順次満了すると推定される
Drug Timeline & Success Rates

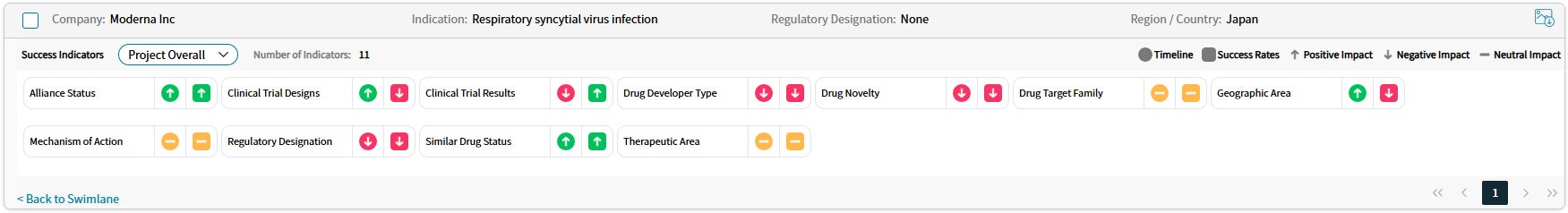
出典:Cortellis Competitive Intelligence, Drug Timeline & Success Rates Prediction current as of October 31, 2024
mRESVIAはRSV予防市場にどのような影響を与えるのか?
-
RSV予防市場への参入者は今後も増え続け、RSVのワクチンおよび予防市場は5年以内に100億ドルに達する可能性があります。
-
既存の2つのワクチンであるABRYSVOおよびAREXVYはいずれも、2023年のレポートでDrugs to Watchとして取り上げましたが、両ワクチンの市場での成功は大きく異なっています。
-
AREXVYは、米国、カナダ、EUおよび日本で最初に導入されたワクチンであり、その後、EUおよび米国において50歳~59歳の高リスク成人への使用が承認されています。米国ではRSVに対するワクチン接種を受けた60歳以上の成人の60%がAREXVYによるワクチン接種を受けており、2023年の世界全体での総売上高である12億3800万ポンド(16億5000万米ドル)に大きく寄与しています。実際、AREXVYの2023年の売上のほとんどは米国におけるものであり3、主として小売り薬局との契約により、現在RSVワクチン市場のシェアをリードしています。しかし、2024年には売上が減速し、2024年の最初の三四半期では4億3200万ポンド(5億5570万ドル)にしか達しませんでしたが、これは2024年~2025年のRSV流行期には変化する可能性もあります4。
-
ABRYSVOには、高齢者(2023年5月)および妊娠者(2023年8月)の両方を含むより広範な集団を対象として発売されたという利点があり、2024年10月には18歳~59歳の高リスク成人向けにも承認されました(50歳未満の成人では初めての承認)。しかし、ABRYSVOの2023年の発売以来の売上高は、AREXVYの2023年の第3四半期のみの売上高とほぼ同額の8億9000万ドルにしか達していません。2024年には母体への接種による売上影響が期待されましたが、収益は主として米国の高齢者への接種によるものでした6。対象集団は拡大されましたが、2024年の最初の3四半期の売上高は3億5600万ドルに減少しました7。
-
その他にも、以下の臨床開発候補が存在します。
-
ADV-110(Advaccine Biopharmaceuticals):RSVに対する遺伝子組換えタンパク質ワクチン
-
BLB-201(Blue Lake Biotechnology 、CyanVac LLC):RSVに対する組換えウイルスベクターワクチン
-
CodaVax-RSV(Codagenix):RSVの弱毒化生ウイルスワクチン
-
D46/NS2/N/deltaM2-2-HindIll (NIAID):RSVに対する組換えウイルスベクターワクチン
-
DS-Cav1(NIAID):RSVに対するタンパク質サブユニットワクチン
-
IVX-A12(Icosavax Inc/AstraZeneca):ヒトメタ肺炎ウイルスおよびRSVに対するウイルス様粒子およびタンパク質サブユニットワクチン
-
mRNA-1045(Moderna Inc):インフルエンザおよびRSVに対するmRNAワクチン
-
mRNA-1230(Moderna Inc):SARS-CoV2、インフルエンザおよびRSVに対するmRNAワクチン
-
mRNA-2365(Moderna Inc):RSVおよびヒトメタ肺炎ウイルス(hMPV)に対するmRNAワクチン
-
MV-012-968(Meissa Vaccines):RSVの弱毒化生ワクチン
-
RSV 6120/deltaNS2/1030s(NIAID):RSVの弱毒化生ウイルスワクチン
-
RSV-276(NIAID):RSVの弱毒化生ウイルスワクチン
-
SP0125(Sanofi):RSVの弱毒化生ウイルスワクチン
-
V-306(Virometix AG):RSVの合成ウイルス様粒子ワクチン
-
VN-0200(Daiichi Sankyo):RSVに対するVAGA-9001a抗原およびMABH-9002bアジュバント
-
VXB-241(Vicebio Ltd):ヒトパラインフルエンザウイルス3型(PIV3)、hMPVおよびRSVに対するタンパク質サブユニットワクチン(同社の分子クランプ技術を使用)
-
VXB-251(Vicebio Ltd):hMPVおよびRSVに対するタンパク質サブユニットワクチン(同社の分子クランプ技術を使用)
mRESVIAはどのような治療上のギャップを埋めるのか?
RSVによる重篤な呼吸器疾患による季節的な入院は、特に乳幼児、幼児、高齢者、およびCOPDや喘息などの基礎疾患を有する患者にとって、公衆衛生上の懸念事項であり続けています。RSVワクチンの承認は、特にRSV感染、インフルエンザおよびCOVID-19の「3種類の感染症の同時流行」が危惧される期間における、感染症抑制、罹患率と死亡率の低減および病院負担の軽減というニーズに大きく貢献するもです。
ブロックバスターとなるために超えるべきハードルは?
3番目に上市されるワクチンとなるmRESVIAは、ABRYSVOおよびAREXVYならびに開発後期にあるその他の複数のRSVワクチンと競合することになります。mRESVIAは、医療従事者による調製を必要としないという他のRSVワクチンにはない利点を有していますが、保存可能期間が短く、完全な有効性を維持するためには超低温での保存が必要であるため、使用場所が制限される可能性があります。さらに、ワクチン接種により複数年の予防効果が期待できるため、毎年接種の必要はないとCDCが示唆したことに加えて、CDC ACIPが2024年半ばに50歳~59歳のRSVワクチン推奨決定を遅らせたことにより、すべてのRSVワクチン販売に支障が生じる可能性があります。