IMDELLTRA
tarlatamab
IMDELLTRA™は、治療が困難で予後不良のES-SCLCに対するファーストインクラスの免疫療法剤です。AmgenのバイスペシフィックT細胞誘導(BiTE ®)テクノロジーを使用したIMDELLTRAは、融合タンパク質の一種であり、T細胞上のCD3とがん細胞上のDLL3の2つの標的に結合します。これにより、T細胞ががん細胞を認識して攻撃できるようになり、がん細胞が溶解されます。DLL3は、化学治療歴にかかわらず、85%を超える患者でSCLC細胞表面に発現しており、正常細胞での発現はごくわずかであることから、魅力的な標的となります。IMDELLTRAはそのMOAから有望視されており、前治療歴を有するES-SCLC患者の標準治療として確立されることが期待されています。

IMDELLTRA一覧
- Amgen
- DLL3およびCD3の両方を標的とするBiTE ®分子
- プラチナ製剤をベースとする化学療法で治療中または治療後に進行が認められたES-SCLC成人に隔週IV投与
- 神経内分泌前立腺癌がんを含むその他のがん適応症についても評価中です
- 約81,000人が2024年のG7市場において再発または難治性の進展型SCLC(二次ラインまたはそれ以降)であると新たに診断されています
なぜDrug to Watchなのか?
SCLCは、急速で制御不能な細胞増殖と早期の転移を特徴とする侵襲性の悪性腫瘍です。現在、再発または難治性SCLCの治療は化学療法が主流ですが、OS中央値は約5カ月にすぎず、大きなアンメットニーズが存在します。
第2相DeLLphi-301試験の きわめて優れた有効性結果により、米国FDAはIMDELLTRAを迅速承認しました。
-
ORR: 40%
-
DOR中央値:9.7カ月。
-
PFS中央値:4.9カ月(フォローアップ中央値10.6カ月)
-
OS中央値:14.3カ月(フォローアップ中央値10.6カ月)
2024年世界肺癌学会(WCLC)で発表された、DeLLphi-301試験に関する16.6カ月のフォローアップ後の最新データからは、プラチナ製剤をベースとする化学療法による治療中または治療後に疾患進行が認められた再発または難治性SCLC患者に対するIMDELLTRAの承認を支持するさらなるエビデンスが提供されています。
-
OS中央値:15.2カ月(フォローアップ中央値20.7カ月)
-
6ヵ月OS率:73.4%
-
PFS中央値:4.3ヵ月
-
ORR: 40%
-
CR: 3%
-
PR: 37%
-
DOR中央値:9.7カ月
-
DCR中央値:70%
-
用量低減に至った有害事象:16%
-
投与中止に至った有害事象:4%
-
少なくともグレード3のCRS:4%
検証目的および適応拡大のため、以下の追加の第3相試験が進行中です。
-
DeLLphi-304試験:プラチナ製剤をベースとする一次化学療法後に再発したSCLCの成人患者の二次治療(再発性または難治性SCLCに対するIMDELLTRAの規制承認のための検証試験)
-
IMDELLTRA vs 標準治療(ルルビネクテジン、トポテカン、アムルビシン)
-
主要評価項目:OS
-
一次完了および試験完了予定:2027年7月
-
DeLLphi-305試験:IMFINZI® (デュルバルマブ;AstraZeneca)および化学療法による一次導入治療を受けたES-SCLC 成人患者の一次治療
-
IMFINZIおよび化学療法による一次導入治療歴のある進展型 SCLC成人患者の一次治療
-
IMDELLTRAとIMFINZIの併用療法 vs. IMFINZI単独療法
-
主要評価項目:OS
-
主要評価項目データ収集完了予定:2027年9月
-
試験完了予定:2028年9月
-
DeLLphi-306試験:化学放射線療法併用後に進行が認められなかった限局型SCLC(LS-SCLC)成人患者
-
IMDELLTRA vs. プラセボ
-
主要評価項目:PFS
-
主要評価項目データ収集完了完了および試験完了予定:2029年10月
審査・承認状況
2023年10月
画期的治療薬指定:米国FDA
2023年12月
優先審査:米国FDA
2024年5月
迅速承認:米国FDA
上市年(実績、予測)
- 2024年:米国
- 2025年:EU、日本
- 2027年:中国本土
2036年に特許存続期間が順次満了すると推定される
Drug Timeline & Success Rates
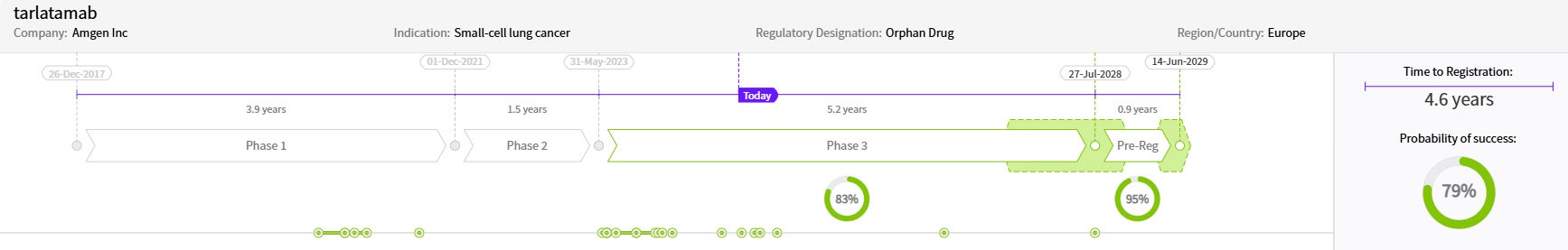

出典:Cortellis Competitive Intelligence, Drug Timeline & Success Rates Prediction current as of October 31, 2024
IMDELLTRAはSCLCの市場にどのような影響を与えるのか?
-
SCLCの薬物治療市場では、売上高が2022年の17億ドルから2032年には58億ドルに成長する(13% CAGR)と予測されています。
-
この増加は、一部には、診断症例数の増加によって薬剤治療可能集団が2022年から2032年にかけて拡大することおよび、再発が一般的であるSCLCでは治療歴のあるSCLC患者に対する薬剤治療率が上昇することに起因しています。このため、薬剤による二次治療率は約70%から76%に、三次治療は約48%から56%へとそれぞれ徐々に上昇して行くと考えられます。
-
さらに、SCLCでは、再発または難治性の患者集団が現在の最も商業的に魅力的な患者集団であり、今後もその傾向は継続していくと考えられます。現在、薬剤治療の対象の半数以上は再発または難治性の患者集団であり、2032年においても同様であると考えられます。二次治療以降での使用が承認されているIMDELLTRAにとっては大きな売り上げが期待されます。
-
三次治療の患者セグメントにおいては、2022年の5300万ドルから2032年には8億1700万ドルへの売上増加が見込まれており、IMDELLTRAとifinatamab deruxtecan (Merck、第一三共)が後期治療での売上に大きく寄与することになります。
-
IMDELLTRAおよびifinatamab deruxtecanは、より有効な後期治療法に対する大きなアンメットニーズへの対処に有用であり、後期治療の選択肢をいくらか多様化することができますが、高価かつ毒性プロファイルの管理が困難であるため、化学療法と競合することは困難です
-
SCLCではプラチナ製剤をベースとする化学療法が非常に有効であり、LS-SCLC およびES-SCLCではほぼ常に全身化学療法が推奨されています。しかし、IMDELLTRAなど新規の有効な治療薬は、特に現在の標準治療との併用という位置づけで迅速にその使用が広まると期待されます。
IMDELLTRAはどのような治療上のギャップを埋めるのか?
SCLCは悪性度の高いがんであり、治療選択肢は限られています。通常、二次治療の奏効期間はわずか3.6~5.3カ月で、OSは8カ月未満です。一般的にLS-SCLCは治癒を目的として治療されますが、ES-SCLC治療では生存期間の延長、疾患進行の遅延および症状の緩和が治療目的となります。ES-SCLCには化学療法がきわめて有効ですが、耐性の発現を回避することは不可能で、ほとんどの患者では後期治療が有効ではなく、多くの患者が重大な副作用を経験し、QOLが低下します。ES-SCLCの一次治療への免疫療法の使用により、二次治療以降における免疫療法の使用が制限されています。したがって、LS-SCLCおよびES-SCLCのOSを延長し、二次治療と三次治療のギャップを効果的に埋める治療へのニーズはきわめて高く、IMDELLTRAはその役割を果たす可能性があります。
ブロックバスターとなるために超えるべきハードルは?
SCLCは併存疾患の数が多く、疾患自体によりさまざまな機能障害が引き起こされるため、毒性や重度の副作用を伴う多くの治療は一部の患者には適切ではありません。新規薬剤であるIMDELLTRAは、患者一人当たりの平均コストが15万5000ドルと非常に高価であることから、標準治療である化学療法およびジェネリックの細胞毒性薬と競合することは困難であると考えられます。また、IMDELLTRAの安全性プロファイルの問題、特にCRSおよびICANSに関する枠組み警告が、毒性管理をさらに複雑にするため、医師による処方の妨げとなる可能性があります。今後IMDELLTRAの競合となり得る薬剤には、新たなDLL3 × CD3バイスペシフィックBI-764532 (Boehringer Ingelheim)と、DLL3、CD3およびCD137を標的とするトリスペシフィック抗体のMK-6070 (Merck)および RG6524 (Roche)があります。IMDELLTRAは、後期治療に使用されることから、その売り上げは、迅速な疾患の進行および短い生存期間に起因する短い治療期間によっても制限されることになります。