GSK-3536819
GSK plcの第一世代ワクチン候補GSK-3536819は、世界中で侵襲性髄膜炎菌感染症(IMD)症例の大半の原因となっている髄膜炎菌の5つの血清群(A、B、C、WおよびY;MenABCWY)を標的とする5種混合ワクチンです。本ワクチンは、GSK plcが既に特許を取得しており、有効性および安全性プロファイルが充分に確立されているワクチンであるBEXSERO(血清群B髄膜炎菌;MenB)およびMENVEO(MenACWY)の抗原成分を組み合わせたものです。

GSK-3536819一覧
- GSK plc
- 髄膜炎菌の5つの血清群(A、B、C、WおよびY)を標的とする、組換えタンパク質および外膜小胞(OMV)を含むコンジュゲート型の5価ワクチン
- 10~25歳を対象とした、6カ月間隔での2回の筋肉内接種による能動免疫化
- 5億6300万人が2024年のG7市場においてMenABCWYワクチン適格者となると推定
- 約600件の新規IMD症例(2024年のG7市場)
なぜDrug to Watchなのか?
MenBとMenACWYの2種類のワクチンを組み合わせて単一のワクチンとすることで、同一の防御レベルを達成するために必要な接種回数が減少し、ワクチン接種率およびワクチン接種スケジュールの順守が改善される可能性があります。
GSK-3536819はPfizer Incの特許取得済み5価ワクチンである PENBRAYA™ に続いて2番目に上市されるワクチンとなりますが、PENBRAYAにはTrumenba®が10歳以上でのみ承認されているという制約がある一方、GSK-3536819には欧州でBEXSEROが 2カ月齢以上で承認されているという利点があります。このため、欧州においてはGSK-3536819のワクチン接種適格者数がより多くなる可能性があります。2030年までに髄膜炎を根絶しようとするWHOの戦略に、これらの多価ワクチンが有用となる可能性があります。
以下の臨床試験において、GSK-3536819が免疫反応誘発に関してBEXSEROおよびMENVEO(対照群)と比較して非劣性(5つの血清群すべてにおいて)であり同様の安全性プロファイルを有することが示されています。
-
10~25歳の健康被験者3,650名にワクチンを2回(Day 1およびDay 181)接種する、第3相国際共同ピボタル試験。本試験はBEXSEROの検証試験としても使用されました。本試験では、ワクチンは110株の多様なB型髄膜炎侵襲性株に対して有効でした。
-
MENEO接種歴(Day 1およびDay 181)のある15~25歳の健康な被験者1,247名にGSK-3536819をDay211に接種する、第3B相臨床試験。MENVEをDay 1に1回接種し、BEXSEROをDay 181およびDay 211に実対照薬として2回接種。
審査・承認状況
2024年4月
BLA受理:米国FDA
2025年2月14日
PDUFA date
上市年(実績、予測):
- 2024年:米国
- 2025年:EU、英国
2012年に特許存続期間が順次満了すると推定される
Drug Timeline & Success Rates
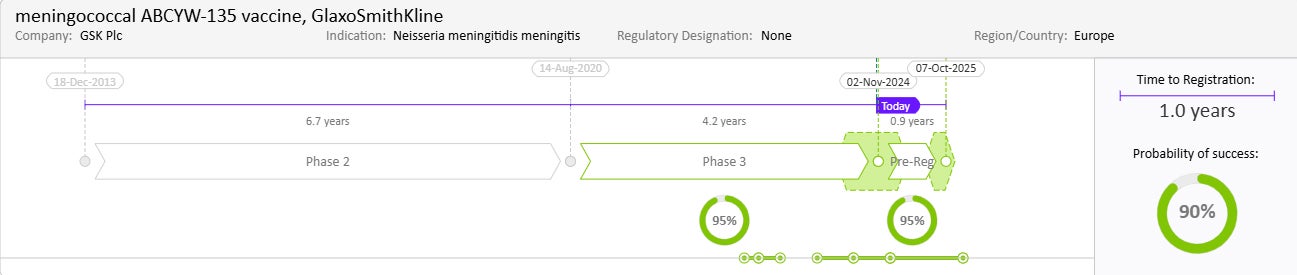
出典: Cortellis Competitive Intelligence, Drug Timeline & Success Rates Prediction current as of October 31, 2024
GSK-3536819は髄膜炎菌性疾患予防市場にどのような影響を与えるのか?
-
GSK-3536819は、同じ5つの血清群(A、B、C、WおよびY)に対する唯一の5価ワクチンとして最初に承認されたPENBRAYAならびに、現在承認されているMenACWYワクチンであるMENVEO、MenQuadfi ®(Sanofi)およびNimenrix i ®(Pfizer Inc)と競合することになります。
-
PENBRAYAおよびGSK-3536819の簡便な接種スケジュールは、医師から好意的に受け取られており、両製品ともその市場には成長の余地があると考えられます。
-
5価ワクチンの普及に伴い、両社のACWYワクチンおよびBワクチンそれぞれの使用は減少すると予想されます。
-
2023年には、BEXSERO(50カ国以上で利用可能)の売上は14%上昇して約8億4900万ポンドに、MENVEO(60カ国以上で利用可能)の売上は12%上昇して約3億8000万ポンドに達していました 。これらの売上と成長の一部が、上市後にGSK-3536819に移行する可能性があります。
GSK-3536819はどのような治療上のギャップを埋めるのか?
IMDは稀ではあるものの、主として小児および青年において、脳損傷や四肢切断などの長期的な影響および生命を脅かす合併症や死につながる可能性のある重篤な疾患です。GSK-3536819によって、世界のIMDのほぼすべての原因である5つの主要血清群の感染を防御するために、Pfizer IncのPENBRAYAに加えて、新たな選択肢が提供され、2種類のワクチンを接種する必要がなくなり、総注射回数をわずか2回に低減することができます。これによりワクチン接種の順守率が上昇し、感染リスクのある集団全体においてワクチン接種が促進される可能性があります。
ブロックバスターとなるために超えるべきハードルは?
疾患に対する認識が低いと、ワクチン接種率が低くなる可能性があります。例えば、米国の青年では髄膜炎菌Bワクチンの1回目の接種率は約31%にとどまり、必要とされる2回の接種を完了した割合は12%未満となっています4。 PENBRAYAには、最初に承認された5価(A、B、C、WおよびY)髄膜炎菌ワクチンであり、すでに米国市場で10~25歳に1年以上前(2023年9月)から利用可能であるという利点があります。世界的に承認されたとしても、GSK-3536819は、財源の限られた国や地域で最も蔓延している株に対する1価のワクチンよりも高価であるため利用が制限される可能性があります。