Fitusiran
第3相試験において、インヒビター保有および非保有の血友病Aおよび血友病Bのいずれの患者においても有効性が示されたことから、fitusiranはすべての血友病患者に対する革新的な治療法となる可能性があります。低分子干渉RNA(siRNA)治療薬であるfitusiranにより、アンチトロンビン濃度を低下させるSerpinPC1 mRNAが阻害および分解されます。これによって、トロンビン産生が促進され、止血バランスの再調整により出血が抑制されます。Fitusiranには、Alnylam® Pharmaceutical IncのESC-GalNAc複合体技術が使用されており、承認のタイミングによっては、初めての二本鎖RNA分子に基づく抗トロンビン低下薬となる可能性があります。

Fitusiran一覧
- Alnylam Pharmaceuticals Inc and Sanofi
- アンチトロンビン標的低分子干渉RNA(siRNA)
- インヒビター保有または非保有の血友病Aまたは血友病Bの予防的治療のために月1回または2カ月に1回皮下投与
- 約4万5000人が2023年にG7市場で血友病Aと診断されています
- 約1万1000人が2023年にG7市場で血友病Bと診断されています
なぜDrug to Watchなのか?
完了した第3相試験のデータからは、fitusiranによる定期補充療法により、凝固因子製剤の出血時補充療法と比較して、年間出血率(ABR)が有意に低下することが示されており、被験者の半数では出血イベントが発現しませんでした。さらに、fitusiranによる定期補充療法により、インヒビター保有または非保有の血友病Aまたは血友病Bの患者において、大手術を安全に行うことが可能となります。安全性への懸念から2020年後半に中断され、その後アンチトロンビンをベースとした投与レジメン(AT-DR)を採用して2021年に再開された試験からも、追加の安全性データが得られています。AT-DRでは、fitusiranによって血栓事象のリスクが軽減され、肝酵素上昇、胆のう炎および胆石の発現率が低下しています。
ATLAS臨床開発プログラムにおいて、fitusiranの有効性および安全性の評価が行われており、以下の完了した第3相試験から結果が報告されています。:
-
インヒビター非保有の血友病Aまたは血友病B患者(12歳以上)120例を対象としたATLAS-A/B試験
-
月1回9カ月間にわたるfitusiran皮下投与による定期補充療法 vs. バイパス止血製剤の出血時補充療法
-
治療を要する出血のABRがfitusiran群では89.9%低下 .
-
ABR中央値:0.0(fitusiran) vs. 21.8(凝固因子製剤の出血時補充療法)
-
治療を要する出血の非発現率:50.6%(fitusiran) vs. 5.0%(凝固因子製剤の出血時補充療法)
-
Fitusiranで注目すべきTEAE:アラニンアミノトランスフェラーゼ(ALT)またはアスパラギン酸アミノトランスフェラーゼ(AST)の上昇(基準値上限の3倍超)がfitusiran群の19%で報告されています
-
インヒビター保有の血友病Aまたは血友病B患者(12歳以上)60例を対象としたATLAS-NH試験
-
月1回9カ月間にわたるfitusiran皮下投与による定期補充療法 vs. バイパス止血製剤の出血時補充療法
-
治療を要する出血のABRがfitusiran群では90.8%低下
-
ABR中央値:0.0(fitusiran) vs. 16.8(バイパス止血製剤の出血時補充療法)
-
Fitusiran群の25例(65.8%):出血事象なし
-
注目すべきTEAEとして、ALTまたはASTの上昇(基準値上限の3倍超)および血栓塞栓症(疑いまたは確定)がfitusiran群の10例(24.4%)で報告
-
凝固因子製剤またはバイパス止血製剤による定期補充療法歴のある、インヒビター保有または非保有の血友病Aまたは血友病Bの重症患者(12歳以上)80例を対象としたATLAS-PPX試験
-
月1回7カ月間にわたるfitusiran皮下投与による定期補充療法 (以前の治療と比較)
-
全出血のABR:2.9 (fitusiran) vs. 7.5(凝固因子製剤またはバイパス止血製剤による以前の治療)
-
自然出血:2.2 (fitusiran) vs. 5.0(凝固因子製剤またはバイパス止血製剤による以前の治療)
-
出血事象なし:44(67.7%;fitusiran) vs. 22 (33.8%;凝固因子製剤またはバイパス止血製剤による以前の治療)
-
SAE:9 (13.4%;fitusiran) vs. 5(7.7%;凝固因子製剤またはバイパス止血製剤による以前の治療)
現在、以下の試験が進行中です。
-
ATLAS-OLE試験:インヒビター保有または非保有の血友病Aまたは血友病B患者(12歳以上)281例を対象とした、ATLAS-A/B試験、ATLAS-INH試験およびATLAS-PPX試験の、非盲検延長試験
-
15~35%のアンチトロンビン標的範囲を維持できるようにデザインされたAT-DR(より低用量、低頻度での投与)を使用した最長48カ月間の月1回または2カ月に1回のfitusiran皮下投与による定期補充療法
-
主要評価項目:TEAEが発現した被験者数
-
副次評価項目:ABR +3
-
完了予定:2026年11月
-
第3相ATLAS-PEDS試験:インヒビター保有または非保有の血友病Aまたは血友病Bの小児患者(1歳以上、12歳未満)32例を対象とした用量設定試験
-
256週間のfitusiran皮下投与
-
主要評価項目:血漿中アンチトロンビン活性値
-
完了予定:2028年8月
-
第3相ATLAS-NEO試験:
-
SOC歴のある、インヒビター保有または非保有の血友病Aまたは血友病Bの重症男性患者(12歳以上)75例を対象
-
6カ月間のSOC歴(凝固因子製剤またはバイパス止血製剤;アンチトロンビン製剤[ATIIIC])、36カ月間のAT-DRを用いたfitusiran皮下投与、最長6カ月間のアンチトロンビン活性のフォローアップ
-
主要評価項目:ABR
-
完了予定:2028年3月
審査・承認状況
2014 年 7 月
オーファンドラッグ指定:EU EMA(血友病A)
2021年2月
ファストトラック承認取得:米国FDA
2023年12月
画期的治療薬指定(インヒビター保有血友病B):米国FDA
2024年5月
MAH提出:中国本土NMPA
2024年6月
NDA受理:米国FDA
2025年3月28日
PDUFA date
上市年(実績、予測):
- 2025年: EU、日本、中国本土、英国、米国
2022年に特許存続期間が順次満了すると推定される
Drug Timeline & Success Rates
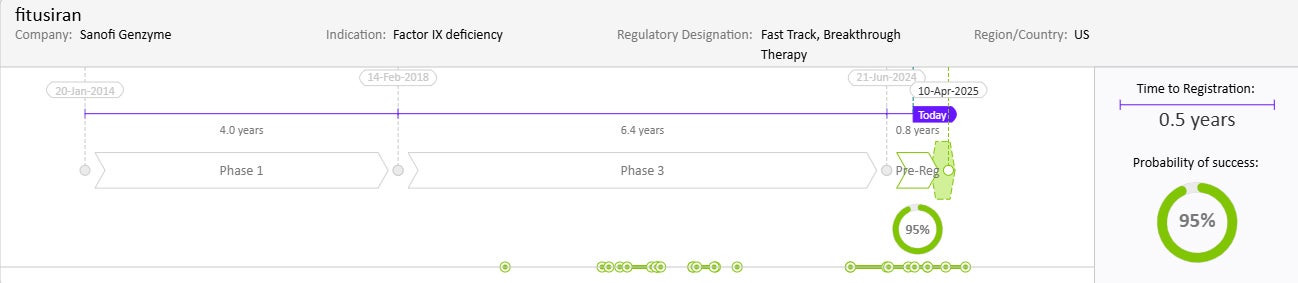
出典: Cortellis Competitive Intelligence, Drug Timeline & Success Rates Prediction current as of October 31, 2024
Fitusiranは血友病Aおよび血友病Bの市場にどのような影響を与えるのか??
-
今後4~5年間に非血液凝固因子製剤および遺伝子製剤が複数導入されることで、血友病Bの治療パラダイムに大きな進歩が期待され、すべての血友病患者に対して有効で便利な複数の治療選択肢が臨床医に提供されます。
-
インヒビター非保有の血友病B患者にとっては、fitusiran、Alhemo™ (コンシズマブ; Novo Nordisk)およびHYMPAVZI™ (マルスタシマブ; Pfizer Inc)など、凝固と抗凝固の不均衡を是正する非血液凝固因子製剤が血液凝固因子製剤よりも便利な選択肢になる可能性があります。しかし、半減期延長型FIX製剤でも同程度の有効性および安全性が得られ、投与負担も低減されているため、疾患が既に十分に管理されている患者においては半減期延長型FIX製剤が治療選択肢となる可能性もあります。HEMLIBRA®(エミシズマブ; Genentech(Roche Group)、中外製薬)、さらにALTUVOCT®/ALTUVIIIO® (Sobi®、Sanofi)の登場によって、血友病A 患者には週1回の非血液凝固因子製剤または血液凝固因子製剤の投与という選択肢が提供されています。したがって、有効性または安全性に明確な優位性がなく、投与負担が同様である新規治療薬が、確立された治療薬を追い越すことは期待できません。
-
一方、皮下投与で投与頻度も少なくて済むfitusiranおよびHYMPAVZIは、既存治療薬からの切替を促進する可能性が高いと考えられます。既治療率が高く市場の大きな拡大が期待できない血友病市場においては、既存治療からの切替が重要となります。実際、今後10年間の市場全体の成長は非常に遅いと予想されます。
-
NovoSeven®(Novo Nordisk)、FEIBA(Takeda)、SEVENFACT®(HEMA Biologics)を含む、出血時補充療法用のバイパス止血製剤は投与負担が大きく出血に対する有効性が低いため、その使用は、患者がHEMGENIX® (tranacogene dezaparvovec;CSL Behring)およびBEQVEZTM(fidanacogene elaparvovec;Pfizer Inc)など、より良好な臨床プロファイル、同様の安全性およびより高い利便性をより低いコストで提供できる非凝固因子製剤および遺伝子製剤の使用へと切替えることで低下すると予想されます。
-
Fitusiranは、4つの市場(インヒビター保有血友病A、インヒビター非保有血友病A、インヒビター保有血友病Bおよびインヒビター非保有血友病B)すべてに大きな影響を与えると予想されます。
-
インヒビター保有血友病B患者に最も大きな影響が生じる可能性が高いと考えられます。
-
KOLによると、血友病Aに関しては、週1回投与のHEMLIBRAと同様のリスクベネフィットプロファイルを有し月1回または2カ月に1回の投与が可能な fitusiranが、HEMLIBRAよりも有利となる可能性があります。月1回の投与では臨床的効果が低くなる可能性があることも示されています。
Fitusiran はどのような治療上のギャップを埋めるのか?
血友病Aおよび血友病Bの治療の主要目的は、出血、特に永続的な関節損傷につながる可能性のある関節内出血の防止です。さらに、もう一つの重要な転帰としてQOLの改善があります。しかし、現在の第VIII因子および第IX因子補充療法の投与経路(すなわち静脈内投与)および第VIII因子補充療法の投与頻度(週1~2回)は、患者にとって大きな負担であり、感染症および血栓症のリスクを増大させ、最適なコンプライアンス率が達成されない原因の一つとなっています。月1回または2カ月に1回の皮下投与治療薬であるfitusiranは、患者の利便性を高め、治療負担を低減させ、治療コンプライアンスを向上させることができます。また、補充療法を受けた患者の20~30%において、ある時点でインヒビターが発現しますが、その治療方法は限られており、合併症罹患率および死亡率が増加します。Fitusiranはこのギャップを埋めるのに役立ちます。
ブロックバスターとなるために超えるべきハードルは?
Fitusiranが参入する市場は、患者層がかなり限られたきわめて競争の激しい市場であり、患者と臨床医の両者が、十分に確立された定期補充療法および出血時補充療法の選択肢を熟知しています。血友病A用のALTUVOCT/ALTUVIIIO、Elocta®/Eloctate®(Sobi、Sanofi))、ADYNOVATE®(Takeda)、 HEMLIBRA および血友病B用のAIDELVION® (CSL Behring)などの治療薬も標準的な半減期延長型治療薬より便利な投与スケジュールを提供します。したがって、既にこれらの薬剤で疾患が良好に管理されている患者にとって、治療薬の切替はそれほど魅力的ではない可能性があります。インヒビター非保有患者の多くは、凝固因子製剤で疾患を良好に管理できているため、非凝固因子治療薬が影響を与えることは困難となる可能性があります。血栓事象の発生などの安全性に関する臨床医の懸念によっても、少なくとも十分なリアルワールドデータが収集されるまでは、fitusiranの初回投与は制限される可能性があります。