EBGLYSS
lebrikizumab
EBGLYSS™は、アトピー性皮膚炎治療のための、IL-13を標的とした第3の生物学的製剤として、L-13DUPIXENT®(デュピルマブ; Sanofi and Regeneron Pharmaceuticals Inc)およびADBRY®/ADTRALZA® (トラロキヌマブ; LEO Pharma)に続いて上市されました。第3の製剤であるとはいえ、EBGLYSSは投与頻度が少なくて済み、IL-13をより高い選択性で阻害し、広範な有効性および安全性データが得られていることから、ステロイド外用剤(TCS)で効果不十分な中等症から重度のアトピー性皮膚炎の治療の第一選択肢となると考えられます。

EBGLYSS について一覧
- Eli Lilly and Co and Almirall
- 抗IL-13mAb
- 成人および体重≥88ポンド(40 kg)かつ12歳以上の小児の中等度から重度のアトピー性皮膚炎治療を目的とした皮下注射
- 十分な臨床反応が得られるまで2週間隔(16週後まで)で投与し、以降は維持用量を月1回投与。
- 2023年のG7市場ではアトピー性皮膚炎の有病者数が約7050万人に至ると推定されています
- アトピー性皮膚炎の有病者数の内、約40%が中等度から重度と推定されています
なぜDrug to Watchなのか?
2020年のEli Lilly and CoによるDermira Incの11億ドルでの買収によって、Eli Lilly and Coの重点領域である免疫分野のパイプラインにEBGLYSSが加わりました。欧州市場ではEBGLYSSはAlmirallにライセンス供与され、生後6カ月の小児患者に対する使用が検討されており、既存のアトピー性皮膚炎治療薬に対する競争力がさらに確立すると期待されています。
EBGLYSSは、TCSの併用有無を問わず使用することが可能であり、初期治療段階(初回および2週目に250 mgをそれぞれ2回ずつ投与し、その後16週目または十分な治療反応が得られるまで250 mgを2週間隔で投与)後、維持用量を月1回投与します。IL-13を標的とした既存の治療薬とは異なり、IL-13Rα1/IL-4Rαヘテロ二量体複合体の形成を阻害できます。
EBGLYSSは、3つの主要な国際共同第3相臨床試験から得られた肯定的なデータに基づいて承認されています。
-
ADvocate 1試験およびADvocate 2試験:中等度~重度の湿疹を有する成人および小児(体重40 kg以上で、12歳以上、18歳未満)
-
52週間、無作為化、二重盲検、プラセボ対照、並行群間比較試験
-
EBGLYSS単剤治療(16週間の治療導入期間:初回および2週目に各500 mg;維持期間:250 mgまたはプラセボを2週間隔で投与)
-
16週目に38%が治験責任医師による包括的な評価(IGA: Investigator’s Global Assessment)スコア0または1を達成(プラセボ群では12%);4週目では10%
-
レスポンダーの77%が月1回の維持投与により1年後においても治療効果を維持
-
16週目でプラセボに切り替えたレスポンダーの48%が1年後においても治療効果を維持
-
痒み点数評価スケール(PNRS: Pruritus Numeric Rating Scale)を用いた測定から、16週目において43%で痒みが軽減(プラセボでは12%)
-
痒みが軽減したレスポンダーの85%が月1回の維持投与により1年後においても治療効果を維持
-
16週目でプラセボに切り替えたレスポンダーの66%が1年後においても治療効果を維持
-
ADhere試験: ベースライン時に、外用剤で十分にコントロールできない中等度から重度のアトピー性皮膚炎および症状を有する成人および小児(体重40 kg以上、12歳以上18歳未満)
-
16週間、無作為化、二重盲検、プラセボ対照、並行群間比較試験
-
TCS併用下でEBGLYSSを投与(初回および2週目2に各500 mg、維持期間に250 mgまたはプラセボを2週間隔で投与)vs. TCSとの併用でプラセボを投与
-
IGA 0または1の達成率が、(EBGLYSS + TCS)群 vs. (プラセボ+TCS)群で41.2% vs. 22.1%
-
アトピー性皮膚炎湿疹スコアの75%達成率(Eczema Area and Severity Index:EASI-75)が、(EBGLYSS + TCS)群 vs. (プラセボ+TCS)群で69.5% vs. 42.2%
その他にも以下の第3相臨床試験が実施されており、将来的には適応拡大が期待されています。
-
ADore試験:中等度から重度のアトピー性皮膚炎を有する青少年患者(体重≥40 kg、12歳以上18歳未満)を対象とした、国際共同非盲検試験
-
EBGLYSSによる52週間の単剤治療(初回および2週目に500mgずつ投与し、4週目から52週目まで250mgを2週間隔で投与)
-
主要評価項目:最終来院時までに有害事象により治験薬の投与を中止した被験者の割合
-
2.4%が有害事象のために治療を中止し、さらに2.4%が重篤な有害事象により投与を中止した
-
65%で1件以上のTEAEが報告された(重症度はほとんどが軽度または中等度
-
62.6%がIGAスコア0または1かつベースラインから2ポイント以上の改善を達成
-
81.9%がEASI-75を達成
-
EASIの平均改善率86.0%
-
ADmirable:米国における、中等度から重度のアトピー性皮膚炎を有する白人以外(自己申告)の成人および小児(12歳以上)を対象とした非盲検試験
-
EBGLYSSによる24週間の単剤治療(500mgを初回および2週目に、4週目~16週目まで250mgを2週間隔で、16週目以降は24週目まで250mgを4週間隔で投与)
-
完了予定:2024年12月
-
ADapt試験:DUPIXENT投与歴があり、外用剤では十分にコントロールできない中等度から重度のアトピー性皮膚炎を有する成人および小児(12歳以上)を対象とする、米国における非盲検試験
-
EBGLYSSによる24週間の単剤治療(500mgを初回及び2週目に、4週目から16週目まで250mgを2週間隔で、16週以降は24週目まで250mgを4週間隔で投与)
-
完了予定:2024年12月
-
ADhope試験:外用剤で効果が得られない中等症から重症のアトピー性皮膚炎を有する成人および小児(12歳以上)を対象とする、ドイツ、オランダ、スペインおよび英国における非盲検試験
-
EBGLYSSによる単剤治療 (500mgを初回及び2週目に、4週目~16週目まで250mgを2週間隔で、16週目以降は24週目まで250mgを4週間隔で投与)
-
完了予定:2025年5月
-
ADjoin試験:先行試験においてEBGLYSSの投与を受け、治験薬投与および最終来院を適切に完了した成人および小児(12歳以上)を対象とする国際共同長期延長試験
-
EBGLYSS単剤治療(2週間隔または4週間隔で100週間)
-
完了予定:2025年4月
-
ADlong試験:ADjoin試験のEBGLYSS治療および最終評価来院(Week 100)を完了した成人および小児(12歳以上)を対象とする、ドイツおよびポーランドにおける長期継続試験
-
EBGLYSS単剤治療(4週間隔で104週間)
-
完了予定:2026年4月
-
ADorable-1試験:中等度から重度のアトピー性皮膚炎を有する小児(生後6カ月以上、18歳未満)を対象とする国際共同RCT
-
EBGLYSSとTCSの併用
-
完了予定:2025年9月
-
ADorable-2試験:ADable 1試験のすべての来院を適切に完了した中等度から重度のアトピー性皮膚炎を有する小児(生後6カ月以上18歳未満)を対象とする長期国際共同延長試験
-
EBGLYSSとTCSの併用
-
完了予定:2026年6月
審査・承認状況
2012年12月
ファストトラック指定:米国FDA
2023年10月
CRL:米国FDA
2023年11月
承認:EU EMA
2023年12月
承認:英国MHRA
2024年1月
承認:日本厚生労働省
2024年9月
承認:米国FDA
上市年(実績、予測):
- 2023年:EU、英国
- 2024年:日本、米国
- 2028年:中国本土
2024年に特許存続期間が順次満了すると推定される
Drug Timeline & Success Rates
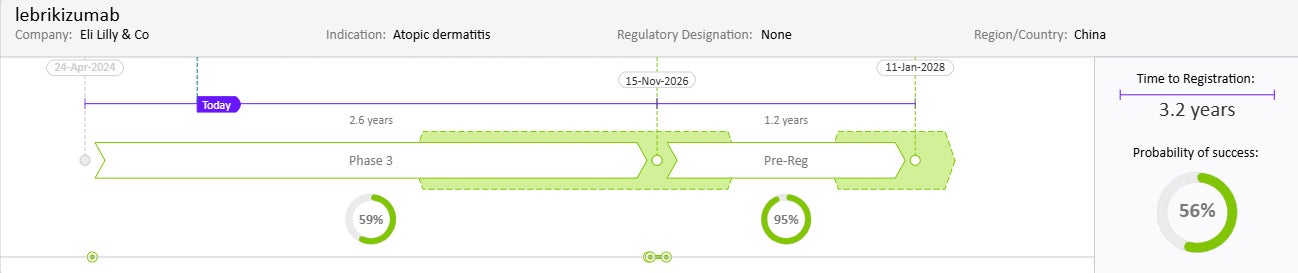
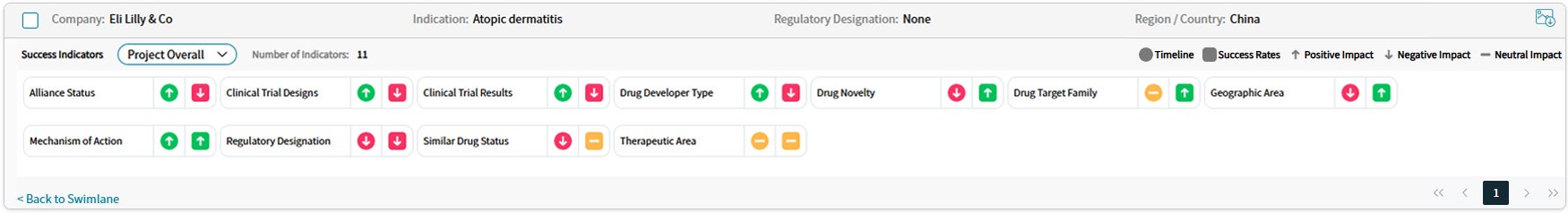
出典: Cortellis Competitive Intelligence, Drug Timeline & Success Rates Prediction current as of October 31, 2024
EBGLYSSはアトピー性皮膚炎市場にどのような影響を与えるのか?
-
TCSはその有効性の実績、低コスト、管理可能な副作用プロファイルに加えて、臨床医がこの薬剤クラスを熟知していることから、アトピー性皮膚炎治療の基本薬となっていますが、TCSよりも有効性の高い全身性の治療薬が必要とされています。
-
2020年以降、8つの治療選択肢が市場参入しており、また今後5年間に複数の新薬が発売される予定であることから、薬物治療を受ける患者数は増加すると考えられます。新薬は中等度から重度のアトピー性皮膚炎患者に有用であり、この患者層が市場の成長を促進すると考えられます。
-
現在の生物学的製剤市場は、2017年に承認され2022年には6カ月の小児にまで適応が拡大されたDUPIXENTが独占しています 。特に、臨床試験結果をサポートするリアルワールドデータが存在し、医師が同剤の使用に精通していることから、この独占状態がここ数年で変化するとは考えられません。
-
しかし、EBGLYSSのような新たな生物学的製剤の導入により治療パラダイムが生物学的製剤の使用へとシフトし、 生物学的製剤の市場シェア全体の拡大につながる可能性があります。中でも、IL-13を標的とした治療薬が売上を独占すると考えられます。
-
EBGLYSSに関しては、忍容性の改善および投与の簡便性が、市場シェアの開拓に有用となる可能性があります。
-
さらに、いくつかの国および地域でアトピー性皮膚炎に対して承認されている経口JAK阻害剤であるCIBINQO® (Pfizer Inc)、 OLUMIANT® (Eli Lilly and Co)およびRINVOQ® (AbbVie)によっても、有効性の高い、経口での治療オプションが提供されています。これらの薬剤がこの市場で大きな収益を生み出す可能性は高いですが、安全性に関してより多くのリアルワールドデータが収集されるまで、これらの薬剤は生物学的製剤での治療後のオプションとして使用されると推定されます。
-
これらの、有効かつ安全でより高価な分子標的薬は、アトピー性皮膚炎治療の主流であり、安価で一般的な外用剤および非分子標的薬に部分的に取って代わる可能性があります。
EBGLYSSはどのような治療上のギャップを埋めるのか?
中等度から重度のアトピー性皮膚炎を有する多くの患者においては、現在利用可能な治療薬では疾患のコントロールが未だに困難であり、特に長期的には治療抵抗性が生じる場合もあり、重度の痒みが日常生活に大きな影響を与える可能性があります。その他にも、アトピー性皮膚炎により、精神衛生上の問題、社会的スティグマ、睡眠不足および仕事や学業への負の影響などが生じます。さらに、アトピー性皮膚炎による皮膚のバリア機能の低下は掻くことでより悪化し、ウイルス、細菌および真菌による皮膚感染症や、連鎖球菌性咽頭炎、耳感染症および尿路感染症(UTI)のリスクが高まります。保湿剤の使用など、その他の治療レジメンに対するアドヒアランスがこのようなリスクを軽減することは可能ですが、負担が伴い、皮膚表面を適切にケアし続けるための一貫した使用が必要です 。DUPIXENTおよびADBRY/ADTRALZAの投与は、注射頻度が一部の患者および介護者にとっては負担となるため、困難となる可能性があります 。利用可能な外用剤では十分にコントロールできない、またはDUPIXENTやその他の新規治療薬に対する反応が不十分な中等症から重度のアトピー性皮膚炎患者は、利便性がより高く、有効かつ安全な非ステロイド性外用剤または全身性の治療薬を必要としています。EBGLYSSでは、投与が月1回で済み、DUPIXENTに比べ結膜炎のリスクが低いことが大きな利点となる可能性があります。
ブロックバスターとなるために超えるべきハードルは?
EBGLYSSの市場での受け入れは、3番目に上市されたIL-13標的治療薬であるという立場および現在利用可能な経口JAK阻害剤との競合によって制限される可能性があります。さらに、アトピー性皮膚炎の多くの患者には、市販薬(OTC)またはジェネリック医薬品が非常に浸透しており、さらに、多くの医師は、再燃を繰り返す中等度から重度のアトピー性皮膚炎に対する予防的アプローチとして、薬効が中程度から強度のジェネリックのTCS(週1または2回の使用)の処方を選択する傾向にあります。このため、より高価な分子標的薬を処方される患者数が制限される可能性があります。また、EBGLYSSなどのより高価な生物学的製剤は償還に課題が生じる可能性もあります。