Vepdegestrant
ARV-471
Arvinas IncとPfizer Incの国際共同研究により生まれたVepdegestrantは、市場初のキメラ型タンパク質分解誘導薬(PROteolysis Targeting Chimera :PROTAC®)となる可能性があります。Vepdegestrantはエストロゲン受容体(ER)タンパク質を標的として分解するようにデザインされており、初期の試験ではPROTACにより誘導されるタンパク質分解が経口の選択的エストロゲン受容体分解薬(SERD)によるタンパク質分解よりも完全であることが示されています。このため、乳癌における内分泌療法抵抗性を克服できる治療が可能となり、この患者集団にとっては画期的な治療薬となる可能性があります。IBRANCE®(パルボシクリブ; Pfizer Inc)との併用を含む適応拡大が検討されています。

Vepdegestrant 一覧
- Arvinas Inc
- Pfizer Inc
- ER PROTAC 分解薬
- ER陽性/HER2陰性の局所進行性または転移性乳がんの成人患者に対する経口投与
- 約9万人が、2024年のG7市場において未治療(一次治療)の転移性HR陽性/HER2陰性乳がんの診断を新たに受けています
- 約11万5000人が、2024年のG7市場において治療経験を有する(二次治療、三次治療)HR陽性/HER2陰性乳がんの診断を新たに受けています
なぜDrug to Watchなのか?
Vepdegestrantは、ER陽性/HER2陰性転移性乳がんに対する単剤療法剤および併用療法に使用する一剤として開発されています。Vepdegestrantは乳がんの分野で最初に第3相開発に到達したPROTAC治療薬であり、第2相VERITAC試験では有望な有効性を示しています。
以下の試験から結果が報告されています。
-
第1b相VERITAC試験(パートC):過去に少なくとも1回の一次内分泌療法を受け、2転移性病変に対する2回以下の化学療法を受けた患者:
-
VepdegestrantとIBRANCEの併用
-
ITT集団(N=46);ESR1変異および野生型患者)
-
87%がCDK4/6阻害薬による前治療を受けていた(78%でIBRANCEが投与)
-
80%がフルベストラントによる前治療を受けていた
-
46%が転移病変に対する化学療法を受けていた
-
ORR:42%(ESR1変異サブグループで47%、N=29)
-
PFS中央値:11.2カ月(ESR1変異サブグループでは13.7カ月)
-
CDK4/6阻害薬による前治療歴のない患者の部分集団:
-
PFS中央値:19.3カ月(6イベント中2イベント)
-
第2相コホート拡大VERITAC試験(パートB):過去に少なくとも1回の一次内分泌療法および2転移性病変に対するCDK4/6阻害薬治療を受けた患者:
-
Vepdegestrant単剤療法
-
ITT集団(N=71;転移性病変に対する前治療レジメン数の中央値が3レジメンのESR1変異および野生型患者)
-
78.9%がフルベストラントによる前治療を受けていた
-
45.1%が転移病変に対する化学療法による前治療を受けていた
-
CBR:38%(ESR1変異サブグループで51.2%)
-
PFS中央値:3.7カ月(ESR1変異サブグループでは5.7カ月)
-
転移病変に対してフルベストラントまたは化学療法のによる前治療を受けていない患者のサブグループ(N=8)
-
CBR: 62.5%
-
PFS中央値:19カ月(8イベント中4イベント)
-
ORR: 29%
ORR: 29%以下の第3相試験が現在進行中です。
-
VERITAC-2試験;CDK4/6阻害薬および内分泌療法による前治療歴を有し、追加内分泌療法(転移病変に対する二次および三次治療)が1回以下の転移性ER陽性/HER2陰性乳がん患者
-
Vepdegestrant単剤療法 vs. フルベストラント
-
2つの主要評価項目:ITT集団およびESR1変異サブグループにおけるPFS
-
トップラインデータ予定: Q4 2024 / Q1 2025
-
VERITAC-3試験:転移性病変に対する前治療もアジュバントCDK4/6阻害薬による治療(転移性病変に対する一次治療)も受けていない内分泌療法感受性患者:
-
VepdegestrantとIBRANCEの併用 vs. レトロゾールとIBRANCEの併用
-
主要評価項目:ITT集団におけるPFS
-
さらに2つのピボタル試験が計画されています(追加データおよび規制当局との合意に関連し、保留中)。
-
一次治療としてのVepdegestrantとAtirmociclibの併用
-
VepdegestrantをIBRANCEまたはその他のCDK4/6阻害薬と併用する2次および3次治療
いくつかの第1/1b相及および第2相試験(TACTIVE-K/N/U/E)において、Vepdegestrantを他の分子標的薬と併用した場合の予備的な有効性および安全性に加えて、術前補助療法における有効性についても検討されています。
審査・承認状況
2023年7月
- Innovative Licensing Access Pathway(ILAP)のイノベーションパスポート指定:英国MHRA
2024年2月
- ファストトラック指定:米国FDA
上市年(実績、予測):
- 2025年:EU、日本、米国
- 2027年:中国本土
2037年に特許存続期間が順次満了すると推定される
Drug Timeline & Success Rates
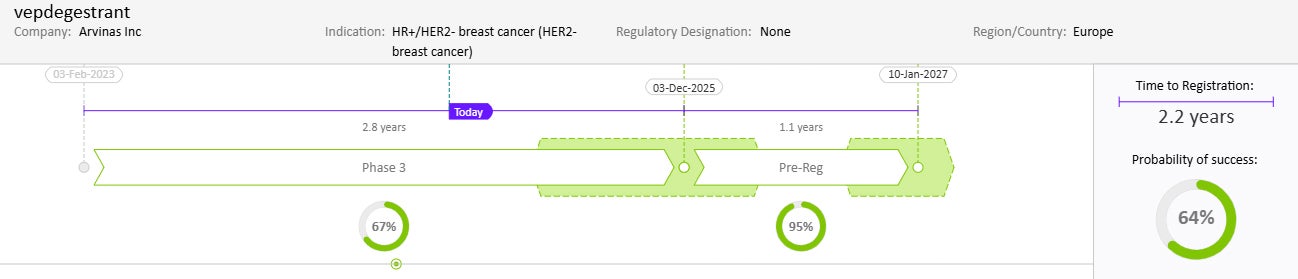
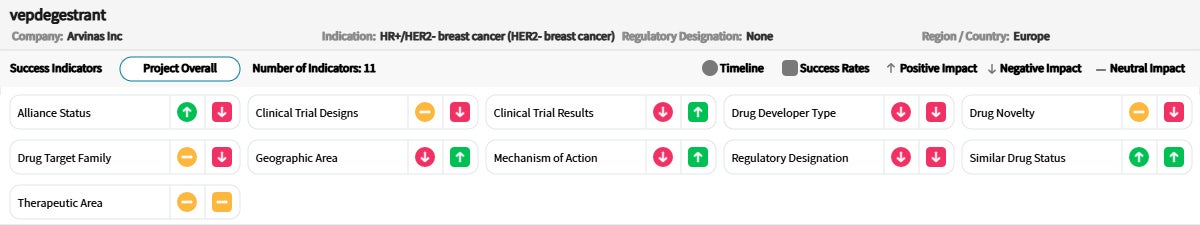
出典:Cortellis Competitive Intelligence, Drug Timeline & Success Rates Prediction current as of October 31, 2024
Vepdegestrantは乳がん市場にどのような影響を与えるのか?
-
乳がんは、新規診断例数の多さ、高い薬物治療率、一般的に治療期間が長い点から、腫瘍分野においては現在のドル価値という観点から最大規模の治療市場の1つとなっています。
-
2033年には、売上高の大半はHER2標的薬およびCDK4/6阻害薬の2つの薬剤クラスが占め、その売上高は約270億ドルに達し、市場シェア全体のほぼ2/3を占めると予測されます。HR陽性/HER2陰性乳がん治療薬の市場は2023年の138億ドルから2033年には232億ドルに増加すると考えられます。
-
ER標的薬のクラス内では、Vepdegestrantおよび経口薬のCamizestrant(AstraZeneca)の市場導入が刺激となって、2033年には次世代薬の売上高が合わせて31億ドル に達すると予想されます。今後数年間に承認される可能性の高い薬剤には 、経口SERDの Imlunestrantover(Eli Lilly and Co)、経口選択的エストロゲン受容体調整薬(SERM)のLasofoxifene(Sermonix Pharmaceuticals Inc)および完全ERアンタゴニスト(CERAN)のPalazestrant (Olema Pharmaceuticals Inc)などがあります。
-
Vepdegestrantは、内分泌感受性の転移性HR陽性/HER2陰性乳がん患者で、転移性乳がんに対して少なくとも1回以上の内分泌療法を受けたことがあり、CDK4/6阻害剤による治療歴(二次および三次治療)のある患者に対する単剤療法として、最初の承認を取得すると予想されます。Vepdegestrantは広い適応(ESR1変異および非変異患者)を取得して、同一の病変の治療に参入することが予測される新規のER標的薬と患者シェアを競うと考えられます。
-
Vepdegestrantは、バイオマーカーで限定されない転移性HR陽性/HER2陰性乳がんを有する患者の一次治療に、IBRANCE(Pfizer Inc)との併用で承認されると考えられます。この治療法は、標準的な内分泌治療薬(レトロゾールなど)を含む既承認のCDK4/6阻害薬をベースとした治療法と競合することになります。
-
他の標的治療薬との併用における転移性HR陽性/HER2陰性疾患の一次治療への適応拡大によって、Vepdegestrantはより大規模で、より収益性の高い市場に参入でき、この市場での売上およびシェアを向上させることができます。
Vepdegestrant はどのような治療上のギャップを埋めるのか?
転移性HR陽性HER2陰性乳がんでは、治療後の多くの患者(約30~40%)において、ESR1遺伝子変異の獲得による再発が認められます。この患者サブグループにおいては、経口SERD ORSERDU ®(エラセストラント;Menarini Group)が、市場における唯一の、有効性が証明されている治療薬です。VepdegestrantはESR1変異型とESR1野生型の両方でタンパク質を分解するため、CDK4/6阻害剤投与後の治療選択肢の一部に加えられると予想されます。現在これらの治療法では(特に標的となり得る変異が認められない)患者において有効性の結果が限られています。さらに、一次治療におけるCDK4/6阻害剤との併用薬として使用することで、標準的な内分泌療法(アロマターゼ阻害剤など)よりもERに起因する腫瘍の生存と増殖を大きく抑制することができ、病勢の進行を遅らせることができます。
ブロックバスターとなるために超えるべきハードルは?
二次治療およびそれ以降の治療に使用する複数のER標的薬が規制当局により承認され上市されることで、競争が激化し、Vepdegestrantの使用が制限される可能性があります。また、ブロックバスターとなるためには、現在IBRANCE(Pfizer Inc)との併用療法で研究が進められている転移性疾患の一次治療での使用への適応拡大の成功が重要となります。