COBENFY
KarXT; xanomeline and trospium chloride
새로 등장했던 조현병 치료제(Acadia Pharmaceuticals의 Minerva Neurosciences의 Roluperidone 등)가 연이어 실패를 겪은 가운데, COBENFY의 승인이 조현병 치료에 획기전인 전환점을 가져올 것이라는 기대를 모으고 있습니다. COBENFY는 새로운 작용 기전을 토대로 조현병 치료제로 승인을 받았으며, 이는 30년 만에 처음 있는 일입니다. COBENFY는 Xanomeline과 Trospium의 FDC를 이용하여 기존의 도파민 경로 대신 Xanomeline 성분을 활용해 M1과 M4 수용체를 선택적으로 표적으로 삼습니다. 반면 염화 Trospium은 혈뇌장벽(BBB)을 눈에 띄게 통과하지 않는 무스카린 수용체 길항제로, 뇌 외부에서 Xanomeline의 콜린성 부작용을 최소화합니다. 현재로서는, 알츠하이머병(AD)과 관련된 정신병에 대해 COBENFY를 써도 좋다는 확실한 결론을 내리기에는 데이터가 부족하지만, 만약 알츠하이머병과 관련된 정신병 환각과 망상 치료에 효과가 입증된다면 상업적 잠재력이 큰 약물이 될 것으로 예상됩니다.

COBENFY™ 개요
- Karuna Therapeutics(Bristol Myers Squibb에 인수됨)
- 듀얼 M1/M4 무스카린 아세틸콜린 수용체 작용제
- 성인 조현병 치료용으로 1일 2회 경구 투여
- 또한 반응이 적절치 않은 조현병 환자와 알츠하이머병 관련 정신병 환자를 대상으로 한 치료제도 개발 중
- 2024년 G7 시장에서 조현병 진단 유병 증례 ~540만 건
- 2024년 G7 시장에서 알츠하이머병과 관련된 정신병 진단 유병 증례 ~320만건
블록버스터 신약 선정 이유
조현병 환자들에게 공통적으로 효과적인 치료법을 찾는 것은 매우 어려운 일입니다. 기존의 약물들은 모두 뇌의 도파민 D2 수용체 신호를 표적으로 하기 때문에 치료 옵션이 제한적이고, 다수의 환자에게 효과가 있는 치료법은 더욱 드뭅니다. COBENFY의 승인은 조현병 치료에서 새로운 선택지가 생겼다는 의미로, 최근 신경정신과 분야에 재진출한 Bristol Myers Squibb에게 중요한 성과로 평가됩니다. 또한, Bristol Myers Squibb는 COBENFY를 처방받은 환자들을 지원하기 위한 프로그램인 COBENFY Cares™를 출시하여, 환자들에게 실질적인 도움을 제공하고 있습니다.
Bristol Myers Squibb는 2024년 3월, COBENFY의 개발사인 Karuna Therapeutics를 인수했습니다. Karuna Therapeutics는 PureTech Health에 의해 설립된 회사로, COBENFY 개발을 진행했습니다. 무스카린 수용체는 1980년대와 1990년대의 연구에서 조현병의 원인으로 지목되었으며, Xanomeline은 과거 Eli Lilly and Co에서 알츠하이머병 관련 정신병과 조현병 치료제로 2상 개발이 진행된 적이 있습니다. 그러나 용량 제한 부작용(위장 부작용 등)으로 개발이 중단되었습니다. Xanomeline이 뇌뿐만 아니라 말초의 M1과 M4 수용체를 활성화했기 때문으로 보입니다. 이 문제를 해결하기 위해 BBB를 통과하지 않는 염화 Trospium이 추가되면서 말초 수용체 차단을 통해 내약성이 개선될 가능성이 높아졌습니다.
COBENFY의 FDA 승인은 위약 대조 임상시험 세 건과 장기 안전성 및 내약성을 평가한 오픈 라벨 임상시험 두 건을 포함해 EMERGENT 임상 프로그램에서 나온 데이터를 기반으로 이뤄졌습니다. COBENFY는 통계적으로 유의미한 조현병 양성 증상과 일부 음성 증상을 개선했으며, 위약 대비 강력한 치료 효과를 보였습니다.
-
EMERGENT-2와 EMERGENT-3: 조현병을 앓고 있는 성인 입원 환자 대상
-
5주 동안 COBENFY와 위약 비교
-
총 양성 및 음성 증후군 척도(PANSS) 점수의 변화:
-
EMERGENT-2: COBENFY -21.2 vs. 위약 -11.6점 (효과 크기=0.61)
-
EMERGENT-3: COBENFY -20.6 vs. 위약 -12.2점 (효과 크기=0.60)
-
임상 글로벌 인상-심각도(CGI-S) 점수의 변화:
-
EMERGENT-2: COBENFY -1.2점 vs. 위약 -0.7점
-
EMERGENT-3: COBENFY -1.1점 vs. 위약 -0.6점
-
부작용으로 치료 중단:
-
EMERGENT-2: 7% vs. 6%(COBENFY vs. 위약)
-
EMERGENT-3: 6.4% vs. 5.5%(COBENFY vs. 위약)
-
치료 효과는 빠르면 2주 만에 입증되었습니다. 그 결과 급성 병원 환경에서 사용이 촉진되었고 외래 환자 환경에서도 지속적으로 쓰였습니다.
-
두 연구에서 특히 흔하게 나타난 부작용은 메스꺼움(19% vs. 4%), 소화불량(18% vs. 5%), 변비(17% vs. 7%), 구토(15% vs. 1%), 고혈압(11% vs. 2%), 복통(8% vs. 4%), 설사(6% vs. 2%), 빈맥(5% vs. 2%), 현기증(5% vs. 2%), 위식도 역류 질환(5% vs. <1%) 등이었습니다.
-
특히 졸음, 체중 증가, 추체외로증상(EPS) 발생률은 위약군과 유사했는데, 이는 기존 치료의 전형적인 부작용으로 치료를 중단하는 이유가 될 수도 있는 요소입니다.
-
EMERGENT-4: EMERGENT-2 또는 EMERGENT-3을 완료한 참가자를 대상으로 한 오픈 라벨 확장, 중간 분석:
-
52주 동안 COBENFY
-
75%가 넘는 참가자가 증상이 30% 이상 호전됨
-
총 PANSS 점수의 변화: -33.3점
-
CGI-S 점수의 변화: -1.7점
-
EMERGENT-5: 성인 조현병 외래 환자를 대상으로 최대 52주 동안 COBENFY를 투여한 오픈 라벨 임상 시험
-
체중 증가, 신진대사 기능 장애 및 추체외로 증상과 무관
또한, 회사는 현재 비정형 항정신병 치료제에 대한 반응이 불충분한 환자를 치료하는 보조 요법으로 COBENFY를 3상과 연장 임상시험에서 평가하고 있으며, 이는 COBENFY용 sNDA를 보조 치료제로 신청하는 데 쓰일 것으로 예상됩니다.
-
ARISE: 현재 비정형 항정신병 치료제에 반응을 충분히 보이지 않는 성인 조현병 환자(미국, 유럽, 일본, 기타)
-
6주 동안 COBENFY와 위약 비교
-
일차 평가변수: 총 PANSS 점수의 변화완료 예정: 2025년 2월
알츠하이머병과 관련된 정신병(예: 환각, 강박, 방황)에 대한 추가 3상 임상시험이 진행 중:
-
ADEPT-1: 중증도 스펙트럼(MMSE: 8~22 포함)에서 정신병(중등도~중증 망상 또는 환각)을 동반한 성인 AD 환자(55~90세)
-
12주 동안 COBENFY(최대 용량으로 적정) 투여
-
응답자들(10주차 또는 12주차에 신경정신과적 인벤토리-임상의: 환각 및 망상(NPI-C: H+D) 점수가 기준치 대비 40% 이상 감소하고 CGI-C 점수가 “개선됨” 또는 “매우 개선됨”)을 26주 동안 COBENFY 또는 위약을 복용하도록 무작위로 배정
-
일차 평가변수: 무작위 배정에서 재발까지의 시간
-
완료 예정: 2026년 10월
-
ADEPT-2: 중증도 스펙트럼(MMSE: 8~22 포함)에서 정신병(중등도~중증 망상 또는 환각)을 동반한 성인 AD 환자(55~90세)
-
14주 동안 COBENFY
-
일차 평가변수: NPI-C의 변화: H+D 점수
-
완료 예정: 2025년 7월
-
ADEPT-3: ADEPT-1 또는 ADEPT-2를 완료한 참가자를 대상으로 한 오픈 라벨 확장 연구
-
52주 동안 COBENFY
-
일차 평가변수: 치료로 인한 이상 사례(TEAE) 발생률
-
완료 예정: 2026년 4월
-
ADEPT-4: 무작위, 이중맹검, 위약 대조, 병렬 그룹 연구
-
최대 14주 동안 COBENFY 사용 가능
-
일차 평가변수: NPI-C의 변화: H+D 점수
-
1차 완료 예정: 2026년 10월
심사 및 승인 현황
2023년 9월
NDA 제출: 미국 FDA(조현병)
2024년 9월
NDA 승인: 미국 FDA(조현병)
실제 및 예상 출시
- 2024년: 미국(조현병)
- 2026년: 중국(조현병)
- 2027년: 미국(AD 정신병), E.U.(조현병[반응이 충분치 않은 자])
- 2028년: E.U.(AD 정신병)
- 2029년: 중국(AD 정신병)
특허 만료 예상시기: 2030년
약물 일정 및 성공 확률
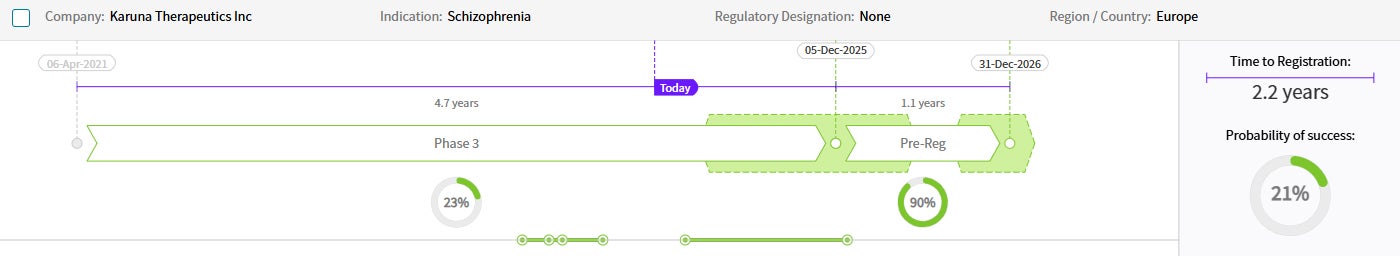
출처: Cortellis Competitive Intelligence, Drug Timeline & Success Rates Prediction, 2024년 10월 31일 기준
COBENFY가 조현병과 정신분열증 시장에 미칠 영향은?
- 조현병 치료 시장은 G7 국가에서 2022년 86억 달러에서 2033년 152억 달러로 연평균 6% 성장할 것으로 전망되며, 이는 약물 치료를 받는 환자 수 증가에 의해 부분적으로 촉진될 것입니다. 또한, 신규 및 차세대 치료제의 판매가 제네릭 약물이 시장에 진입하는 영향을 상쇄할 것으로 보입니다.
- 경구용 비정형 항정신병 약물은 조현병의 1차 치료제로서 확고한 입지를 유지할 것으로 보입니다. 의사들이 해당 약물의 효능과 안전성, 내약성에 익숙하고, 제네릭 약물(예: Aripiprazole, Risperidone, Olanzapine)이 널리 사용되기 때문입니다.
- 향후 몇 년 내 출시될 두 신약, 즉 COBENFY와 Iclepertin (Boehringer Ingelheim, 글리신 수송체-1 억제제) 중에서는 후자가 매출에 더 큰 영향을 미칠 것으로 예상됩니다. 미충족 수요가 높고 유병률이 높은 조현병과 관련된 인지 장애(CIAS)를 다스리기 때문입니다.
- COBENFY는 조현병 치료를 위한 새로운 작용 기전(MOA)을 가진 약물에 대한 수요를 충족하는 데 기여할 것으로 예상됩니다. COBENFY는 단독 요법뿐만 아니라, 다른 약물에 충분히 반응하지 않거나 부작용을 경험한 조현병 환자들에게 항정신병 약물의 보조 요법으로도 사용될 가능성이 높습니다. 2033년까지 미국에서 최대 13%의 환자 점유율을 차지할 가능성도 있습니다.
- COBENFY는, 초기에는 2차 또는 후기 단독 요법으로 쓰일 것으로 예상됩니다. 환자가 다른 치료에 불충분하게 반응하는 양성 또는 음성 증상을 보이거나 부작용을 견디지 못하는 상황이 오기 전에는 보험사들이 먼저 제네릭 처방을 권장할 가능성이 있기 때문입니다.
- COBENFY가 2주 만에 효과가 나타나는 것으로 입증된 만큼, 입원 중인 급성 조현병 환자에게도 처방할 수 있으며, 치료에 반응하는 환자에게는 외래 치료도 가능합니다.
- 알츠하이머병 관련 정신병의 경우, 독특한 작용기전, 알츠하이머병 관련 정신병에 대한 표시, 노인의 사망 위험에 대한 박스형 경고가 없다는 점 때문에 COBENFY의 복용률이 높아질 가능성이 있지만, 이미 자리 잡은 저렴한 비정형 항정신병 약물과의 경쟁은 불가피할 것으로 보입니다.
- 인구 고령화와 함께 알츠하이머병의 유병률, 진단율, 치료율이 모두 상승하고 있습니다.
- TCOBENFY의 성공으로 무스카린 파이프라인의 성장이 이어졌습니다. 최근에는 신경정신과 약물에 관심이 있는 제약회사들로부터 투자가 줄을 잇기도 했습니다.
COBENFY은 어떤 치료 공백을 메울 수 있는가?
뇌의 도파민 D2 수용체 신호를 표적으로 하는 기존 조현병 치료제는 환각과 망상 같은 “양성” 증상을 어느 정도 완화할 수 있지만, 무감동증, 정서적 금단, 인지 장애와 같은 “음성” 증상을 치료하지 못합니다. 또한, 진정, 체중 증가, 추체외로 증상 등 부작용은 치료 지속성을 저해하고 복용량을 제한할 수 있습니다. 조현병 환자의 약 20~30%는 치료에 불응하거나 내성을 보이며, 이들 환자는 고용량 또는 다약제 요법으로 인해 부작용과 순응도 저하 위험이 증가합니다. COBENFY는 신종 MOA를 통해 이러한 치료 공백을 메우고, 정신분열증 치료의 새로운 패러다임을 제공할 가능성이 있습니다.
알츠하이머병 관련 정신병 및 초조는 환자에게는 고통을, 간병인에게는 부담을 주며, 시설 입소의 주요 원인이 되기도 합니다. 이러한 증상을 안전하고 효과적으로 치료할 수 있는 약제에 대한 수요가 높은 가운데, 승인된 약물은 REXULTI®(Otsuka America Pharmaceutical Inc와 Lundbeck) 하나뿐입니다. 그러나 이 약물은 효과가 미미하고, 고령의 치매 환자에게는 뇌혈관 질환 발생 위험을 증가시킬 수 있습니다. COBENFY는 이러한 치료 공백을 메울 수 있는 약물로 주목받고 있습니다.
블록버스터 신약이 되기 위해 극복해야 하는 문제는?
항정신병 약물의 판매는 낮은 순응도와 이행도로 인해 제한될 수 있습니다. COBENFY는 다른 항정신병 약물보다 내약성이 우수하지만, 조현병 관련 인지 장애에 대한 효과가 제한적일 수 있으며, 번거로운 요법 및 잦은 투여로 인해 이행도가 저하될 가능성이 있습니다. 임상의들 또한 긴 보정 기간, 다른 항정신병 약물과의 경쟁, 임상시험에서 높은 치료 중단율, 음성 증상 관련 서면 데이터 부족 등으로 인해 COBENFY를 1차 치료제로 처방하는 것을 주저할 수 있습니다. COBENFY의 가격은 월 1,850달러로, 현재 시판 중인 대부분의 일반 항정신병 약물보다 훨씬 비쌉니다. 이로 인해 경제적 여건이 좋지 않은 조현병 환자들이 보험 적용을 받지 못하거나 불충분한 혜택을 받을 가능성이 있습니다. 유럽 및 일본 시장에서는 EMA가 요구하는 조현병 약물 승인에 필요한 장기 임상 연구 데이터 부족과 일부 시장의 긴 HTA 절차, 일본 내 시험기관 부족으로 인해 출시가 지연될 수 있습니다. 이러한 요인들은 COBENFY가 블록버스터 신약으로 자리 잡는 데 있어 극복해야 할 주요 과제가 될 것입니다.