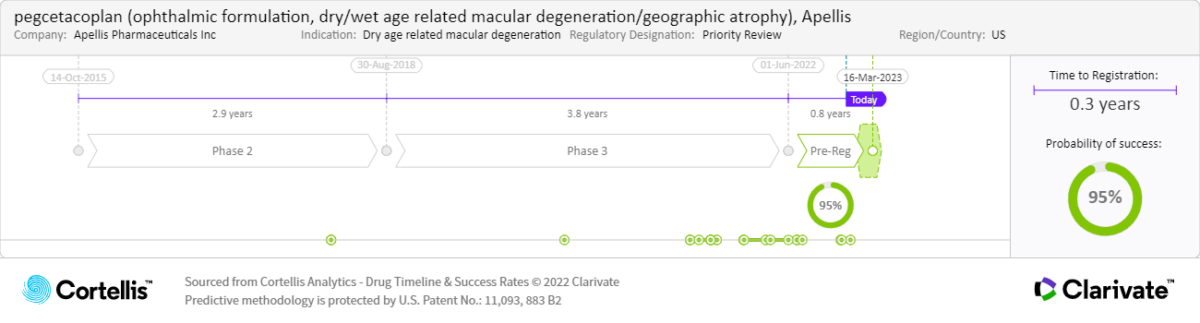
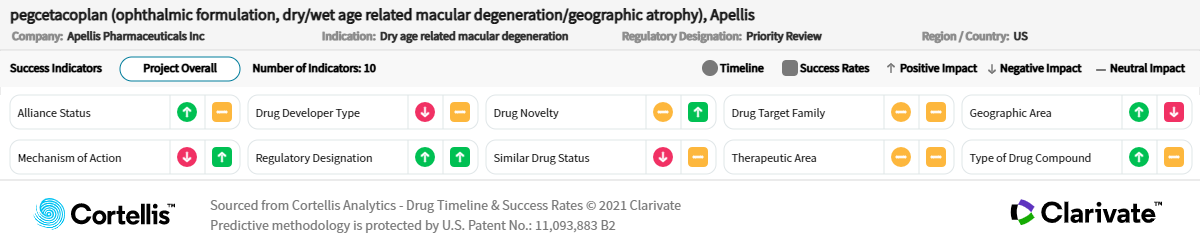
關於Pegcetacoplan
-
生產商:Apellis Pharmaceuticals Inc.
-
補體 C3 抑制劑。
-
每週兩次,經泵皮下輸注給藥,用於治療 PNH。
-
每月或每隔一個月一次,玻璃體內給藥,用於治療繼發於 AMD的 GA。
-
目前也在對 Pegcetacoplan 用於治療免疫複合物膜增生性腎小球腎炎(IC-MPGN)、C3 腎小球病(C3G)、肌萎縮側索硬化(ALS)、冷凝集素病(CAD) 和造血幹細胞移植相關血栓性微 血管病(HSCT-TMA)進行研究。
-
2021 年 G7 市場的 PNH 患病率為2.0 例/10 萬人。
-
2021 年 G7 市場約有 230 萬例 GA病例