關於Teclistamab
-
生產商:嬌生旗下楊森製藥
-
靶向 BCMA 和 CD3 的雙特異性抗體
-
每週皮下注射治療 R/R 多發性骨髓瘤
-
2021 年 G7 市場約有 7.2 萬例多發性骨髓瘤確診病例

TECVAYLI®
在分別獲得 歐盟委員會(EC)和 FDA 的附條件和加速核准後,Teclistamab 是首款靶向 B 細胞成熟抗原(BCMA)的雙特異性抗體,應用於多發性骨髓瘤的治療。基於一項針對既往接受過至少三線治療並在末次治療中出現疾病進展的復發或難治性(R/R)多發性骨髓瘤患者的關鍵性 I/II 期試驗,對該藥物核准上市。正在進行的 III 期試驗預計將在 Teclistamab 的核准背景下確認臨床獲益,並進行其他多發性骨髓瘤患者人群的標籤擴展,包括與其他已核准藥物聯合用藥。對於這種無法治癒並經常復發的疾病,Teclistamab 有望成為重要的補充治療手段。


Teclistamab 是一種T 細胞重定向、靶向BCMA 和CD3 的首創雙特異性抗體獲准藥物;目前正在研究在多發性骨髓瘤治療中的應用。
2021 年 6 月
•突破性治療認定:美國 FDA
2021 年 12 月
•BLA 遞交,授予優先審評資格:美國 FDA
2022 年 1 月
•MAA 遞交:EMA
2022 年 8 月
用於既往接受過至少 3 線治療(免疫調節劑、蛋白酶體抑制劑和 CD38靶向抗體)並在末次治療中表現出疾病進展的 R/R 多發性骨髓瘤患者
•CMA:EC
2022 年 10 月
用於既往接受過至少 4 種治療(免疫調節劑、蛋白酶體抑制劑和 CD38靶向抗體)的 R/R 多發性骨髓瘤患者
•加速批准:美國 FDA
預期和實際上市時間
•2022:歐洲和美國
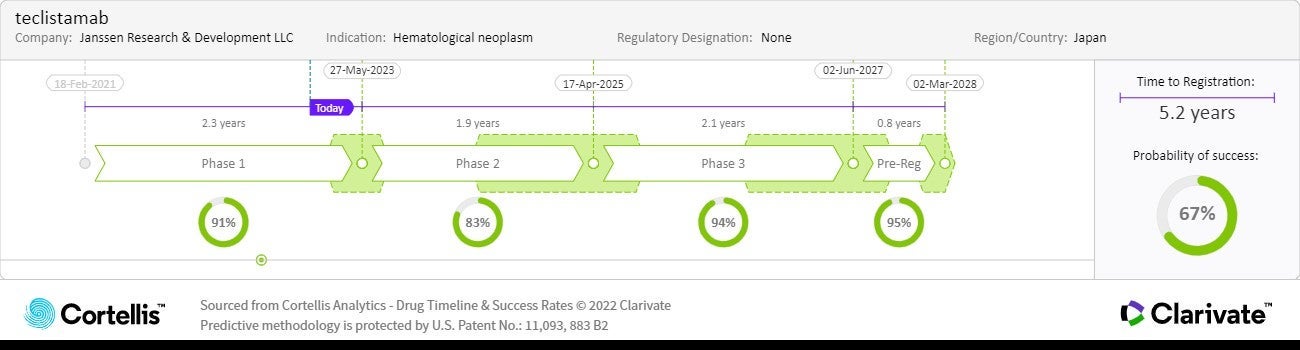
2023:日本
預計專利從 2036 年開始陸續到期