關於Bimekizumab
-
生產商:優時比
-
人源化 IgG1 單株抗體(mAb)
-
前 5 次治療每 4 周皮下注射一次,之後每 8 週一次,治療中重度斑塊型乾癬
-
正在進行用於治療中軸型脊柱關節炎、乾癬性關節炎和化膿性汗腺炎的研究
-
2021 年 G7 市場約有 1170 萬例症狀性乾癬病例
-
80–90%的銀屑病患者患有斑塊型乾癬

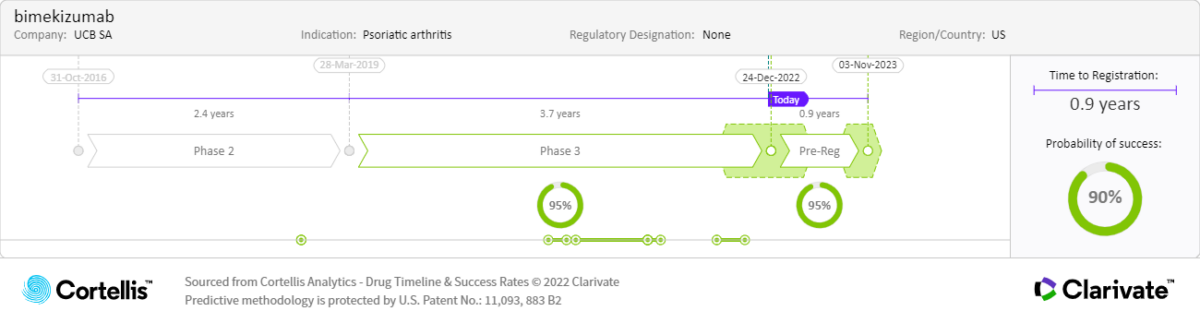
作為首款治療斑塊型乾癬的雙特異性 IL-17 A/F 抑制劑,Bimekizumab 可能僅在減少皮膚和關節發炎以及病理性骨形成(乾癬症狀負擔的主要原因)方面比 IL-17A 抑制劑更有效,並且副作用比目前的一些治療方案(包括泛 IL-17 抑制劑)更少。歐盟委員會(EC)、日本厚生勞動省(MHLW)、加拿大衛生部和澳大利亞治療用品管理局此前已核准該藥用於治療中重度斑塊狀乾癬,預示著有望獲得美國食品藥品監督管理局(FDA)的核准。


Bimekizumab 是首個治療中重度斑塊型乾癬的 IL-17 A/F 雙重抑制劑。III 期試驗結果顯示,皮膚清除效果優於現有療法。其給藥頻率低,具有良好的安全性特徵,可能對臨床醫生和患者具有吸引力。