關於Deucravacitinib
-
生產商:必治妥施貴寶
-
變構 TYK2 抑制劑
-
每日 1 次口服治療中度至重度斑塊型乾癬
-
還研究了用於膿皰性乾癬、乾癬性紅皮症、乾癬性關節炎、系統性紅斑狼瘡和發炎性腸道疾病的治療
-
2021 年 G7 市場約有 1170 萬例症狀性乾癬病例
-
症狀性乾癬病例的平均年齡為45 歲

SOTYKTU™
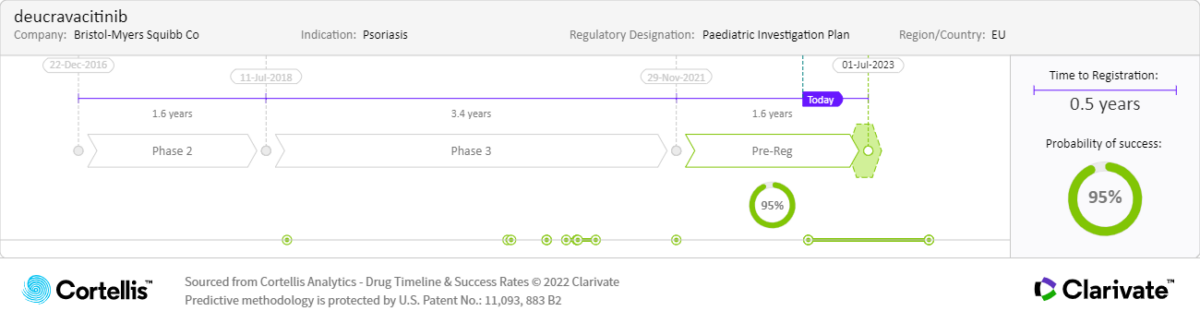
繼美國食品和藥物管理局(FDA)於 2022 年 9 月核准 Deucravacitinib 之後,在歐洲和日本也有望獲得核准。作為一種新型的口服靶向藥物,它可以選擇性地抑制酪氨酸激酶 2(TYK2,一種介導細胞激素驅動的免疫和發炎訊號的 Janus 激酶(JAK)家族成員),有可能填補斑塊型乾癬治療手段的空白。除了對這些患者的影響外,該藥物還被評估用於其他適應症,可以使更多的患者群體受益,並促進整體銷售。


Deucravacitinib 是一種首創的口服 TYK2 抑制劑,具有獨特的作用機制,可抑制 IL-23、 IL-12 和 I 型干擾素(IFN)的信號傳遞,它們是參與多種免疫介導疾病發病機制的關鍵細胞激素,目前正在對 Deucravacitinib 進行評估。
POETYK PSO-1(Deucravacitinib vs 安慰劑)和 POETYK PSO-2(Deucravacitinib vs 每日兩次 Apremilast/ Otezla®)兩項三期臨床試驗的結果支持了美國 FDA 的核准,這兩項試驗在美國、歐洲和日本的中度至重度斑塊型乾癬成人患者中開展,結果顯示:
2022 年 9 月
•用於適合全身治療或光療的中重度斑塊型乾癬病患者:
•批准:美國 FDA,MHLW
2022 年 11 月:
•上市:日本
預期上市時間
•2022:美國
•2023:歐洲
預計專利從 2033 年開始陸續到期