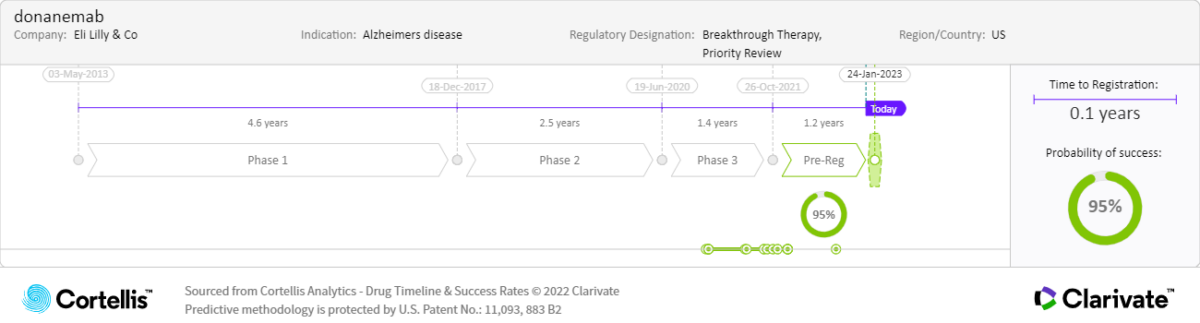
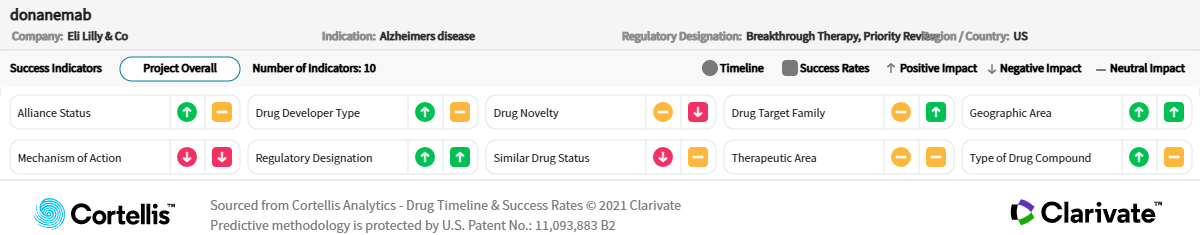
關於Donanemab
-
生產商:禮來。
-
抗 Aβ N3pG Mab
-
I每 4 週一次,靜脈輸注給藥,用於治療阿茲海默症和輕度阿茲海默症引起的 MCI。
-
全球約有 4000 萬阿茲海默症患者。
-
由於人口老齡化,預計到 2031 年, G7 市場早期阿茲海默症患者的總人數將增加 35% 以上。

美國食品藥品監督管理局(FDA)在 2021 年加速核准用於治療早期阿茲海默症的 ADUHELM™(Aducanumab),但這一做法引發了爭議,由於缺乏臨床醫生的支持和醫療保險的覆蓋範圍,該藥物的商業化道路受阻。目前,在一項具有里程碑意義的 III 期臨床試驗資料的支援下,下一代抗 Aβ 單克隆抗體(MAb)Lecanemab 已獲得美國 FDA 的加速核准並準備在美國以外的國家/地區上市,品牌名稱為 LEQEMBI™。在正在進行的試驗獲得相應結果之前,Lecanemab 可能會被 Donanemab 和其他同類藥物(例如羅氏的 Gantenerumab)效仿。如果 Lecanemab 獲准,不良事件(AE)、便利性以及臨床有效性和生物標記有效性方面的差異將是未來人們選擇和採購該藥物的關鍵決定因素。


美國 FDA 基於生物標記的臨床終點(即大腦中澱粉樣蛋白水準降低)加速核准了 ADUHELM,由此其他疾病進程改變療法(DMT)也基於相似的資料提交美國法規機構申請核准。 Lecanemab 的 III 期試驗結果可用於驗證此類藥物的臨床有效性,為該藥物獲得全球法規機構核准奠定了基礎,同時也預示 Donanemab 的 III 期試驗將獲得令人滿意的結果(待公佈)。