關於Mirikizumab
-
生產商:禮來
-
人源化 IgG4 單株抗體。
-
每月一次,靜脈給藥或皮下給藥,用於治療克隆氏症和中重度活動性潰瘍性結腸炎。
-
克隆氏症:2021 年 G7 市場約有 180 萬例確診病例
-
潰瘍性結腸炎:2021 年 G7 市場約有 230 萬例確診病例
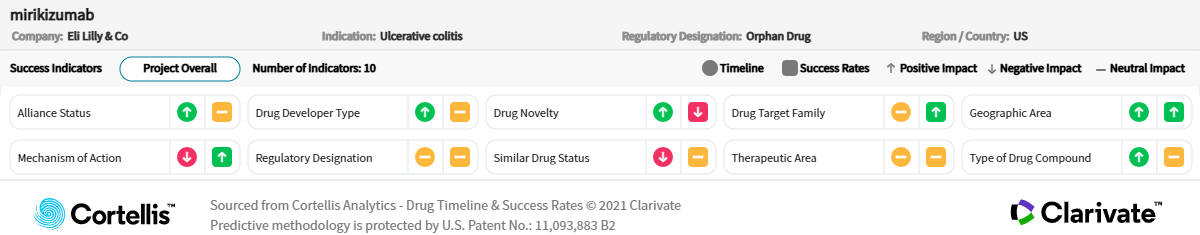
Mirikizumab 是一種靶向 IL-23 p19 次單元的單株抗體,可能成為用於治療潰瘍性結腸炎的首創藥物,也可能成為獲准用於治療株氏症的第三種藥物。作為一組具有新作用機制的新療法中的一員,Mirikizumab 的出現將有助於不斷增長此類新療法的市佔率,並可能為患者提供更有效且更持久的治療選擇。


潰瘍性結腸炎
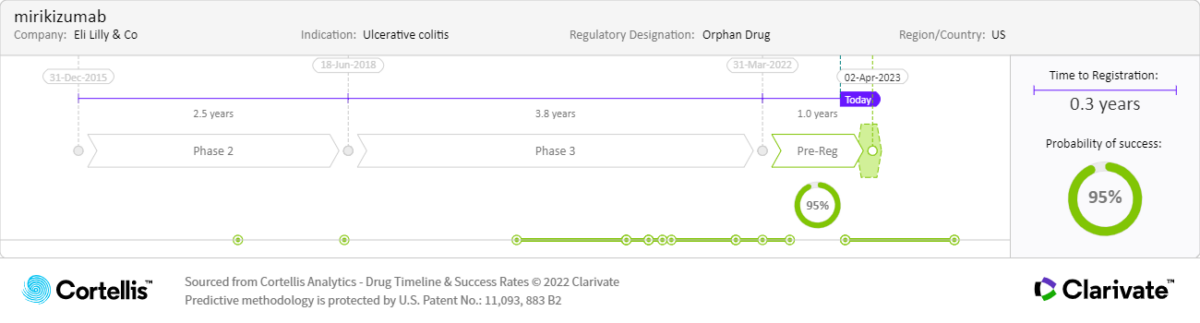
2022 年 3 月
•生物製品許可申請(BLA)遞交:美國食品藥品監督管理局(FDA)
•上市許可申請遞交:歐洲藥品管理局(EMA)
2022 年第二季度:
•上市許可申請遞交:日本厚生勞動省(MHLW)
預期上市時間:
•克隆氏症-2025:美國、日本和歐洲
•潰瘍性結腸炎-2023:美國、日本和歐洲
預計專利從 2034 年開始陸續到期
Mirikizumab 將如何影響株氏症和潰瘍性結腸炎市場?
Mirikizumab 填補了哪些治療空白?
克隆氏症和潰瘍性結腸炎的特徵均表現為病程間斷,急性發作期在前,緩解期在後。患有這兩種疾病的患者除了生活品質較差外,還存在需要住院治療和接受手術干預等風險。這兩種疾病都無法治癒,因此對於患有這兩種疾病的患者,藥物治療的目的是誘導急性發作症狀緩解、維持緩解(不使用皮質類固醇)和改善生活品質。Mirikizumab 可能有助於填補以下治療空白:持續性長期緩解(許多患者對生物製劑治療無反應),用作治療對 TNF- 抑制劑不耐受或耐藥的患者採用其他作用機制的療法。
要達到“重磅藥物”地位,可能需要克服哪些障礙?
Mirikizumab 的上市時間晚於用於治療克隆氏症和潰瘍性結腸炎的 STELARA 和其他 IL-23 抑制劑,這可能會對其使用率產生影響。對於 STELARA,在新型 IL-23 抑制劑最初上市時,胃腸病學家對 STELARA已有 6-8 年的處方經驗,因此至少在此期間,新型 IL-23 抑制劑不太可能會顯著影響 STELARA 的用藥患者,但新型 IL-23 抑制劑可主要用作後線治療藥物。此外,預計在 2023 年上市的生物類似藥ustekinumab也可能會影響所有 IL-23抑制劑的使用率。除非 Mirikizumab 的安全性和有效性優於其他藥物,否則在上市藥物數量越來越多的市場環境中, Mirikizumab 終將成為許多治療選擇之一,而非唯一治療選擇。