關於Teplizumab
-
生產商:Provention Bio Inc
-
抗 CD3 單株抗體
-
每日靜脈給藥,持續 12-14 天,以延遲高風險人群進展為臨床 T1DM
-
2021 年 G7 市場約有 180 萬例 T1DM病例

Teplizumab 是首款針對 T1DM 的免疫治療藥物,並且鑒於其具有保留 β 細胞功能和延遲胰島素治療需求的潛在能力,因此是一種具有里程碑意義的藥物。


Teplizumab 是一種 Fc 受體非結合性抗 CD3 單株抗體,根據在 8 歲至 17 歲未診斷為 T1DM 但有親屬患有 T1DM 的高風險兒童和青少年中進行的 II 期風險試驗的結果,美國食品藥品監督管理局(FDA)授予突破性治療資格認定。在研究中,該藥物延遲或預防了 T1DM的發生。III 期 PROTECT 正在進行中,評估 Teplizumab 在過去 6 周內確診的 8歲至 17 歲兒童和青少年中的有效性和安全性。該研究的結果也將支持 2021 年美國 FDA 在完整回應函(CRL)中要求提供額外的藥代動力學/藥效學(PK/PD)資料。
2019 年 10 月
•優先藥物(PRIME)資格認定:歐洲藥品管理局(EMA)
2022 年 2 月
•生物製品許可申請(BLA)
2022 年 11 月 17 日
•核准:美國 FDA
2022 年12月:
•美國上市實際上市時間
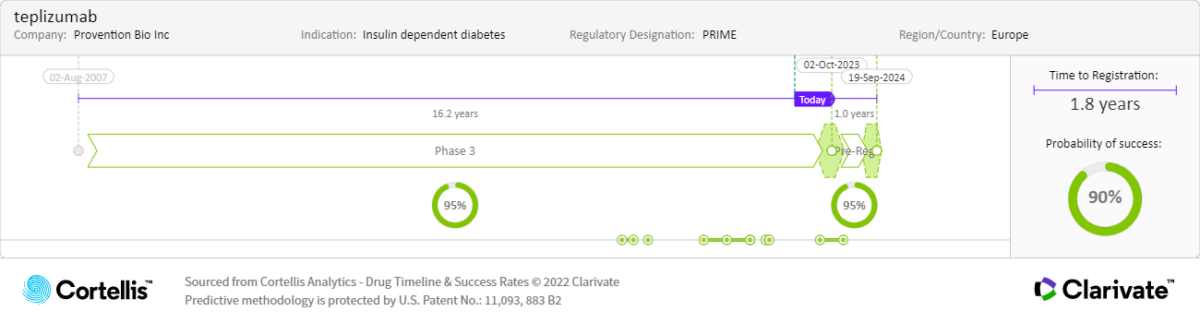
•2024:歐洲
預計專利從 2026 年開始陸續到期