Teclistamab 소개
-
Janssen Pharmaceutical Companies of Johnson & Johnson
-
Bispecific antibody targeted at BCMA and CD3
-
재발성 또는 불응성 다발성 골수종 치료 목적으로 매주 피하 주사
-
2021년 기준 G7 시장의 다발성 골수종 진단 사례 72,000건.

EC 및 FDA에 각각 조건부 및 가속 승인을 받은 Teclistamab은 다발성 골수종 치료를 위해 B세포 성숙화 항원(BCMA)을 표적으로 작용하는 최초의 이중 특이성 항체입니다.Teclistamab은 최소한 3차 (EC승인)또는 4차(FDA승인)치료를 받은 경험이 있고 최종 치료 당시 질병이 진행된 재발성 또는 불응성(R/R) 다발성 골수종 환자를 대상으로 한 중요한 1/2상 시험을 기반으로 조사 및 승인되었습니다.현재 진행 중인 3상 임상시험은 Teclistamab이 승인된 조건에서 임상적 이점을 확인하고, 이를 통해 승인된 타 제제와 병용 투여를 포함, 복수의 다른 다발성 골수종 환자군에서 라벨이 확장될 것으로 예상됩니다.Teclistamab은 재발하는 경우가 많은 이 불치병을 치료하는 새로운 치료제로 각광받을 것으로 보입니다.


Teclistamab은 BCMA 및 CD3를 표적으로 하는 first-in-class 기성약품(off-the-shelf)으로 T세포 경로변경 이중 특이성 항체이며, 현재 다발성 골수종 치료제로 사용될 수 있도록 연구 진행 중입니다.
2036년 부터 만료될 것으로 예상되는 특허
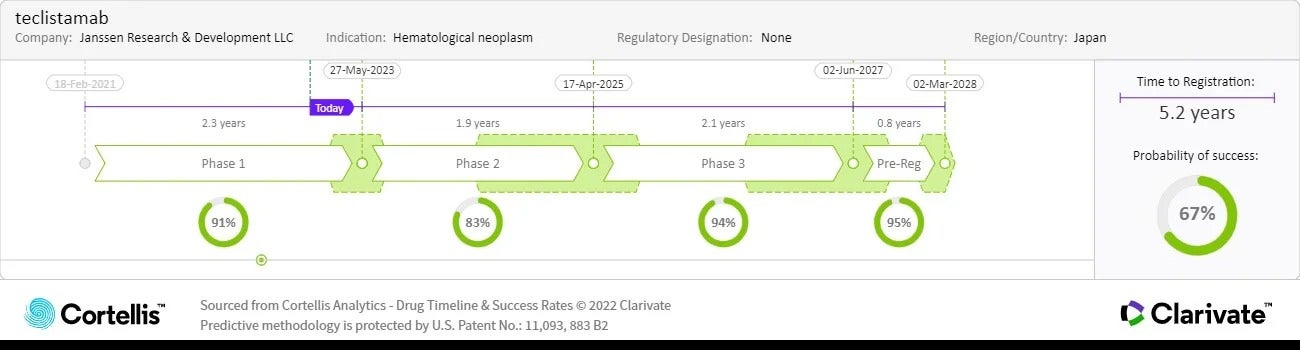
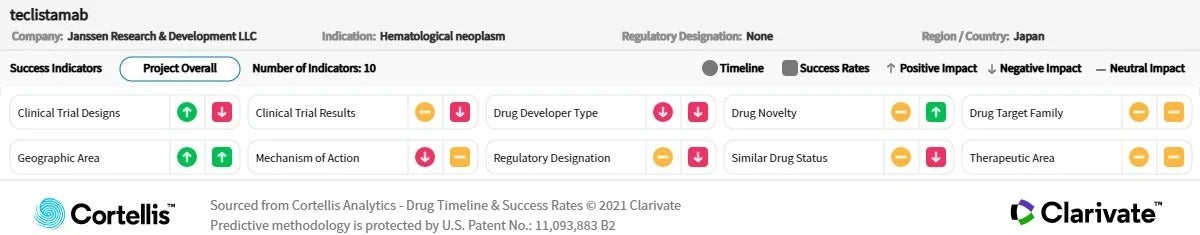
– 출처: Cortellis Competitive Intelligence, Drug Timeline & Success Rates Prediction 2022년 12월 15일