Mirikizumab 소개
-
Eli Lilly and Company
-
Humanized IgG4 monoclonal antibody
-
크론병 및 중등도에서 중증의 활동성 궤양성 대장염 치료 목적으로 매월 정맥 또는 피하 투여
-
크론병:2021년 기준 G7 시장에서 진단된 유병 사례 180만 건
-
궤양성 대장염:2021년 기준 G7 시장에서 진단된 유병 사례 230만 건
IL-23의 p19 서브유닛을 표적으로 하는 단일클론항체 Mirikizumab은 궤양성 대장염에 대한 first-in-class 약제이자 크론병에 대해 승인된 3번째 약제가 될 것으로 보입니다.새로운 작용 기전을 가진 최신 치료법 중 하나인 본 치료법은, 해당 치료법의 시장 점유율을 상승시키는데 기여할 것으로 보이며, 환자들에게는 보다 효과적이며 장기적인 치료법으로써 자리매김할 가능성을 가지고 있습니다.


궤양성 대장염
2022년 3월:
• BLA 제출: U.S. FDA
• 판매 허가 신청서 제출: EMA
2022년 2분기:
• 판매 허가 신청서 제출:MHLW
출시 예상일:
• 크론병-2025: 미국, 일본,유럽
• 궤양성 대장염 – 2023: 미국, 일본, 유럽
2034년 부터 만료될 것으로 예상되는 특허
Mirikizumab 이 크론병 및 궤양성 대장염 치료제 시장에 미칠 영향은?
Mirikizumab은 어떤 치료 공백을 메울 수 있는가?
크론병과 궤양성 대장염 모두 간헐적으로 진행되는 특징을 갖고 있으며, 급성 발현 후 관해됩니다.이로 인해 환자는 입원과 외과 수술을 받아야 할뿐만 아니라, 삶의 질도 떨어집니다.두 질병 모두 치료법이 없기 때문에 약물 요법으로 급성 발현을 관해시킨 다음 그 상태를 유지하고(코르티코스테로이드 투약 없이) 삶의 질을 향상시키는 것을 목표로 합니다.Mirikizumab은 장기적인 관해(상당수 환자들이 생물학적 제제에 불응), TNF-α 억제제에 불내성, 불응성을 보이는 환자들의 경우에는 대체 치료법으로 치료 공백을 줄일 수 있습니다.
Mirikizumab이 블록버스터 신약이 되기 위해 극복해야 하는 문제는?
Mirikizumab은 크론병과 궤양성 대장염 치료제인 STELARA®를 비롯한 기타 IL-23 억제제 대비 늦게 출시되었기 때문에 경쟁 제품 대비 사용도가 떨어질 수 있습니다.STELARA®의 경우, 위장병 전문의는 약 6~8년간 STELARA®를 처방해왔을 것이고, 적어도 초장기에는 최신 IL-23 억제제가 높은 시장 점유율을 점하긴 어려울 것이고 주로 나중 단계에 사용되는 치료제로 사용될 수 있을 것입니다.또한, 바이오시밀러 ustekinumab이 2023년 출시될 것으로 예상되는 가운데, 이로 인해 모든 IL-23 억제제의 점유율이 크게 떨어질 가능성이 있습니다.Mirikizumab이 상당한 안전성과 효능을 보이지 않는 한, Mirikizumab은 경쟁 제품이 점차 늘어나고 있는 이 시장에서 여러 치료법 중 하나로 치부되게 될 것입니다.
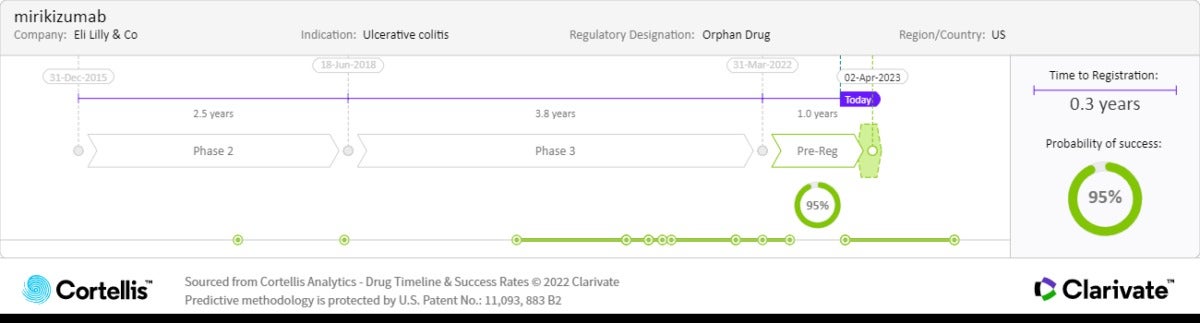
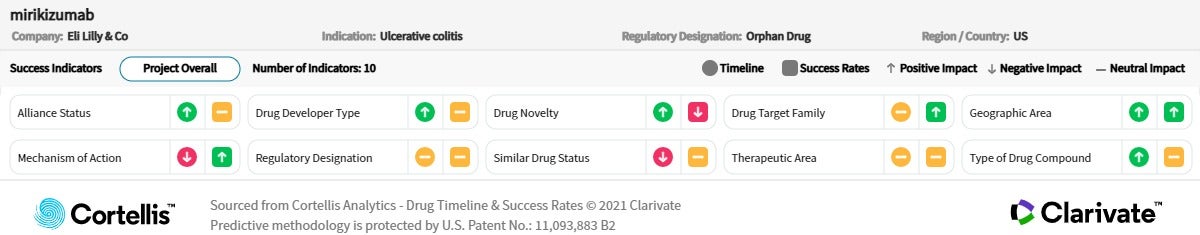
<출처: Cortellis Competitive Intelligence, Drug Timeline & Success Rates Prediction, 2022년 12월 15일>