Bimekizumab 소개
-
UCB
-
Humanized IgG1 monoclonal antibody (mAb)
-
첫 5회 치료 시 4주마다 피하주사 투여, 그 후 중등증 내지 중증 판상 건선 치료 시 8주마다 투여.
-
축형 척추관절염, 건선성 관절염, 화농성 한선염 치료 연구 진행 중.
-
2021년 기준 G7 시장에서 증상을 수반한 건선 사례 1,170만 건
-
건선 환자의 80~90%는 판상 건선 환자.

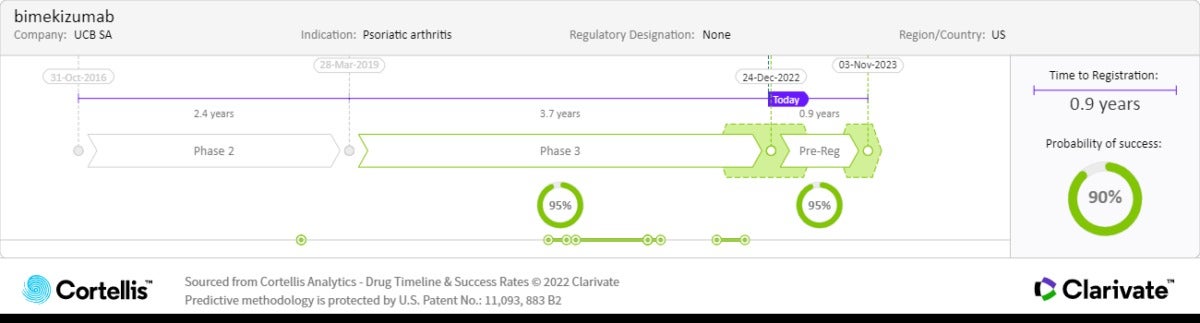
최초의 판상 건선 치료용 이중 특이성 IL-17 A/F 억제제인 Bimekizumab 은 건선 증상을 일으키는 주 원인인 피부 및 관절 염증과 병리학적 골 형성의 감소에 대해서는 IL-17A 억제제 대비 효과적일 수 있으며, pan-IL-17 억제제를 포함한 현재 가용한 치료법보다 부작용이 적습니다. 유럽 위원회(EC), 일본 후생노동성(MHLW), 캐나다 보건부(Health Canada), 호주 식약청(Therapeutic Goods Administration)에서 중등도에서 중증 판상 건선 치료제를 사전 승인했다는 점은 향후 미국 식품의약국 (U.S. Food and Drug Administration, FDA)의 승인을 받을 가능성이 높다는 점을 시사합니다.


Bimekizumab은 중등증 내지 중증 판상 건선을 치료하는 최초의 이중 IL-17 A/F 억제제입니다.임상 3상 결과 기존 치료제 대비 현저한 효능을 보였습니다.적은 투여 회수와 우수한 안정성 프로파일로 임상의와 환자에게 각광받을 것입니다.