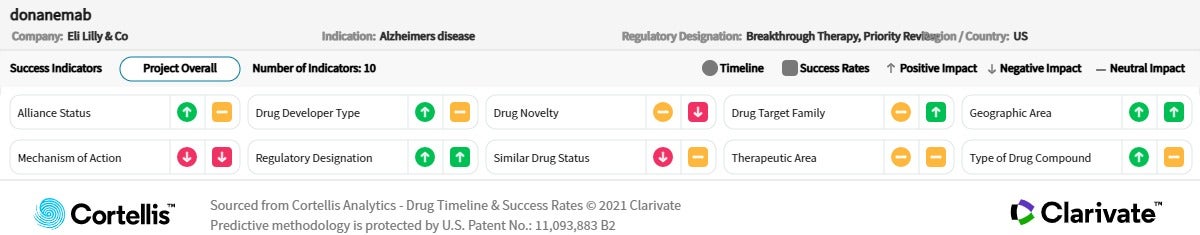
Donanemab 소개
-
Eli Lilly and Company
-
Anti-Aβ N3pG MAb
-
알츠하이머병 및 경증 알츠하이머병으로 인한 경도인지장애(MCI) 치료 목적으로 4주마다 정맥내주입
-
전세계 알츠하이머 환자는 4,000만 명
-
인구 노화로 2031년 기준 G7 시장의 초기 알츠하이머병 사례 총 35% 증가 예상

2021년 U.S. FDA가 초기 알츠하이머병 치료제인 ADUHELM™ (aducanumab)을 신속 승인한 것을 두고 논란이 일고 있습니다. 또한 임상의 지원 부족과 노인의료보험 보장이 되지 않는 점도 ADUHELM의 활용이 크게 축소되었습니다.하지만 임상 3상의 획기적인 결과에 힘입어, 차세대 항아밀로이드베타 단일클론항체(MAb) Lecanemab이 미국 FDA의 가속 승인을 받고 LEQEMBI™라는 브랜드로 시판되어 미국 외 지역에서 출시될 것으로 예상됩니다. Donanemab을 비롯한 동 계열의 다른 약물(Roche의 Gantenerumab 등)도 임상 결과에 따라 Lecanemab의 전례를 따를 수 있습니다.FDA가 Lecanemab을 승인할 경우, 차별화된 약물이상반응, 편의성, 임상 및 바이오마커면에서의 효능이 향후 활용도를 결정짓는 주요 요인이 될 것입니다.


FDA가 바이오마커 평가지표(뇌내 아밀로이드 수치 감소)을 기반으로 ADUHELM 을 신속 승인한 뒤로 타 원인조절치료제(DMT)의 유사한 데이터를 기반으로 미 규제기관 승인 신청의 문을 열었습니다.Lecanemab에 대한 3상 임상결과는 해당 약물군의 임상적 효능을 검증하고 좋은 위치에서 글로벌 규제 승인을 받을 수 있도록 해, 현재 보류 상태인 Donanemab도 3상 임상에서 좋은 결과를 받을 수 있을 것으로 기대됩니다.