Mirikizumab 소개
-
제조사: Eli Lilly and Company
-
인간화 IgG4 항-인간 IL-23p19 mAb
-
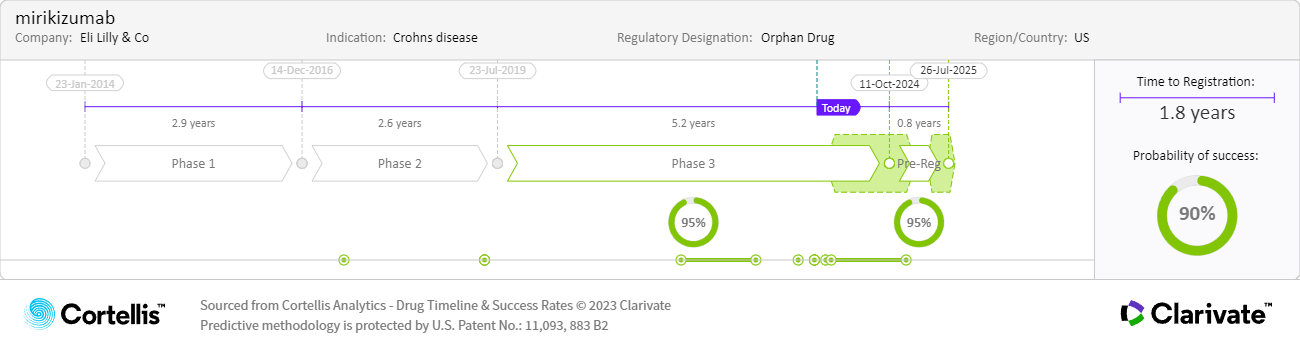
크론병 및 중등도에서 중증의 활성 궤양성 대장염 치료를 위해 0주, 4주, 8주 정맥 주입으로 구성된 유도 용량과 이후 매월 피하 주사로 투여하는 유지 용량
-
크론병: ~180만 건 2021년 G7 시장에서 진단된 유병 증례
-
궤양성 대장염:~230만건 2021년 G7시장에서 진단되 유병 증례

IL-23의 p19 서브유닛을 표적으로 하는 단일클론 항체(monoclonal antibody, mAb)인 mirikizumab은 EMA와 미국 FDA에서 궤양성 대장염의 계열 내 최초 요법으로 승인되었으며, 크론병에 대해서는 계열 내 3번째로 승인될 가능성이 높습니다. 2023년 블록버스터 신약(Drugs to Watch 2023)에 포함되었지만, 미국 FDA의 제조 우려로 인해 미국 출시가 지연되어 2024년 블록버스터 신약에도 오르게 되었습니다.
새로운 작용 기전을 갖는 신종 치료법 세트의 일부로 Mirikizumab은 이들 요법이 차지하는 시장 점유율을 높이고 잠재적으로 환자에게 더 효과적이고 오래 지속되는 치료 옵션을 제공하는 데 기여할 것입니다.

궤양성 대장염
2022년 3월
2023년 3월
2023년 4월
2023년 5월
2023년 6월
2023년 10월
실제 및 예상 출시:
크론병
궤양성 대장염
특허만료 예상시기: 2034년 이후
Mirikizumab이 크론병 및 궤양성 대장염 치료제 시장에 미칠 영향은?
Mirikizumab은 어떤 치료 공백을 메울 수 있는가?
크론병과 궤양성 대장염은 모두 간헐적인 질병 경과를 특징으로 하며, 급성 발적(flare) 후 관해 기간이 이어집니다. 이로 인해 환자는 삶의 질이 저하될 뿐만 아니라 입원 및 외과적 중재가 필요하게 될 위험이 있습니다. 두 질환 모두 치료법이 없기 때문에 약물 요법은 급성 발적의 완화를 유도하고 (코르티코스테로이드 없이) 관해 상태를 유지하며 삶의 질을 개선하는 것을 목표로 합니다. Mirikizumab은 특히 효과적인 장기 치료 옵션이 거의 없는 환자 집단에서 의사와 환자가 사용하는 데 도움이 될 수 있는 유리한 안전성 프로파일을 가지고 있습니다. Mirikizumab은 지속적인 장기적 관해(많은 환자들이 생물학적 제제에 대한 반응 소실), TNF-α 억제제에 불내성 또는 내성을 보이는 환자들의 경우에는 대체 기전을 갖는 요법으로 치료 공백을 줄일 수 있습니다.
Mirikizumab이 블록버스터 신약이 되기 위해 극복해야 하는 문제는?
크론병과 궤양성 대장염 모두에 대해 STELARA 및 기타 IL-23 억제제에 이어 Mirikizumab이 나중에 시장에 진입하면 그 점유율이 제한될 가능성이 높습니다. STELARA의 경우, 소화기내과 전문의들이 7~9년 동안 처방한 임상 경험이 있기 때문에 적어도 초기에는 새로운 IL-23 억제제가 환자 점유율을 크게 빼앗지 않을 것이며 주로 이후 차수 요법으로 사용될 수 있을 것입니다. 또한 2024년에 출시될 것으로 예상되는 바이오시밀러 ustekinumab의 출시는 모든 IL-23 억제제의 사용을 잠식할 수 있습니다. Mirikizumab은 점점 더 혼잡해지는 치료 환경에서 여러 치료 옵션 중 하나가 될 것입니다.