本記事は英文ブログを日本語に翻訳再編集(一部追記を含む)したものです。本記事の正式言語は英語であり、その内容・解釈については英語が優先します。
クラリベイトのがん領域エキスパートは、中国本土からのASCO 2021のアブストラクトを分析し、オンコロジーの展望に影響を与えると予想される重要なトレンドと画期的な治療法を明らかにしました。
2021年のASCO年次総会では、中国本土の企業が強く注目されました。ドラッグランドスケープに大きな影響を与えることが予想される治療法にスポットを当てたDrugs to Watch™シリーズの一環として、クラリベイトのChina In-Depth™のエキスパートが中国本土からの200以上の抄録をレビューし、以下のようないくつかの注目すべきトレンドを確認しました。
- 中国本土の企業による口頭発表の数が、ASCO 2020では11件だったのに対し、ASCO 2021では20件と大幅に増加
- 固形がんを対象とした革新的な治療法の重要な臨床試験で、有望な結果を発表する中国企業の数が増加
図1:ASCOにおける中国本土からの口頭発表の数
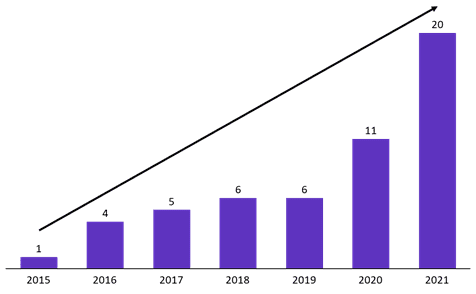
出典: ASCO meeting library
1. アベマシクリブ、HR陽性/HER2陰性のハイリスク早期乳がんの再発率低下に効果を発揮し注目を集める
アベマシクリブ (イーライリリーのVerzenio) は、中国本土では初のCDK4/6阻害剤として、HR陽性/HER2陰性のハイリスク早期乳がんに対する承認を取得することに1
背景:中国本土では現在、HR陽性/HER2陰性の早期乳がんの再発リスク低減を目的とした薬物療法はありません。複数のCDK4/6阻害剤が、この高リスク乳がん患者層のアジュバント療法として評価されています。
ASCOでのアップデート:イーライリリーは、HR陽性/HER2陰性の早期乳がん患者を対象に、アベマシクリブと標準的なアジュバント内分泌療法 (ET) を併用する場合とET単独の場合を比較する、重要な第3相MonarchE試験に登録された中国の患者集団の結果を発表しました。CDK4/6阻害剤は、主要評価項目である無浸潤生存期間だけでなく、無遠隔転移生存期間においても有効性を示しました。また、中国の患者における安全性プロファイルは、世界中の患者で観察されたものと同様でした。
今後の展望:今回の結果は非常に有望であり、HR陽性/HER2陰性の高リスクの早期乳がんに対する術後補助療法としてのアベマシクリブの適応拡大を後押しするものと思われます。中国本土では、多くのCDK4/6阻害剤 (Jiangsu Hengrui Medicineのdalpiciclibなど) が開発されていますが、アベマシクリブには遠く及ばないため、イーライリリーは競争の激しい領域で大きな先行者利益を得ることができます。
2. Dalpiciclibは、再発転移性HR陽性/HER2陰性乳がん市場において、他のCDK4/6阻害剤と患者シェアを争う可能性がある
中国の医師は、治療が困難なこの患者集団に対する新たな治療オプションを歓迎するだろう2
背景:2020年12月、Jiangsu Hengrui Medicineは、再発転移性HR陽性/HER2陰性乳がんを対象とした重要な第3相臨床試験 (DAWNA-1) において、dalpiciclib(SHR6390)が主要評価項目を達成したことを発表しました。これらの結果に基づき、Jiangsu Hengrui Medicineは、中国本土において、この治療設定のためにdalpiciclibとフルベストラントの併用療法のNDAを申請し、2021年4月に優先審査資格を得ました。
ASCOでのアップデート:Jiangsu Hengrui Medicineは、ピボタルな第3相 (DAWNA-1) 試験の結果を発表しました。ASCOで発表されたデータは、dalpiciclibとフルベストラントの併用が、プラセボとフルベストラントの併用に比べて、この患者セグメントの無増悪生存期間 (PFS) を有意に改善し、管理可能な安全性プロファイルを示しています。
今後の展望:承認されれば、dalpiciclibは、2018年7月にファイザーのパルボシクリブ、2021年1月にイーライリリーのアベマシクリブに続き、この患者層に対してNMPAで承認された3つ目のCDK4/6阻害剤となります。CDK4/6阻害剤 (フルベストラントとの併用) が再発転移性乳がん患者の病勢進行を遅らせるという有意な改善を示していることを考慮すると、この薬剤クラスはこの設定において好ましい治療オプションとしてすぐに浮上する可能性があります。
3. ピロチニブ/トラスツズマブは、HER2 陽性乳がん患者のネオアジュバント療法としてのペルツズマブ/トラスツズマブの地位に挑戦できるか?
ピロチニブ (Aruini) は初期の段階で有効性の兆候を示していますが、ネオアジュバント治療におけるその完全な可能性を分析するには、さらに多くのデータが必要3
背景:Jiangsu Hengrui Medicineは、中国本土において、HER2陽性の早期乳がんのアジュバント療法として、ピロチニブ (トラスツズマブおよび化学療法との併用) を検討しています。
ASCOでのアップデート:Jiangsu Hengrui Medicineは、HER2陽性の早期乳がんのアジュバント療法としてのピロチニブの第2相試験の結果を発表しました。その結果、ピロチニブをトラスツズマブと化学療法に併用することで、トラスツズマブと化学療法を併用した場合と比較して、全病理学的完全奏効 (tpCR) を約2倍と大幅に改善しました。また、この患者集団において管理可能な安全性プロファイルを示しています。
今後の展望:本剤の臨床効果を適切に評価するためには、主要評価項目であるtpCRに加えて、副次評価項目である無イベント生存期間、無病生存期間、無遠隔転移生存期間、客観的奏効率などのデータが重要となります。また、中国本土において、ピロチニブとトラスツズマブを併用した化学療法と、トラスツズマブを併用した化学療法の安全性と有効性を評価するための重要な第3相臨床試験を実施しています。この試験でピロチニブとトラスツズマブの併用療法に良好な結果が得られれば、ネオアジュバント治療の市場シェアにおいて、ペルツズマブとトラスツズマブの併用療法に挑戦することになると期待されています。
4. AumolertinibがEGFR陽性の転移性NSCLCのファーストライン治療に有効であることを証明
ポジティブな第3相データにより、aumolertinib (Ameile) は、ファーストラインの転移性非小細胞肺がん (NSCLC) セグメントにおいて、唯一の第3世代EGFR阻害剤であるosimertinib (Tagrisso) の競合薬として浮上することに4
背景:2021年2月に発表された良好な第3相試験結果に基づき、Hansoh Pharmaは、中国本土におけるEGFRエクソン19欠失またはL858R変異を有するファーストラインの転移性患者の治療を目的とした革新的な第3世代EGFR阻害剤オウムセルチニブについて、2021年4月に画期的治療薬の指定を受け、2021年5月に優先審査資格を取得しました。
ASCOでのアップデート:重要な第3相臨床試験の結果、オモラリティニブはゲフィチニブと比較してPFSと奏効期間 (DoR) を有意に延長し、安全性プロファイルも良好であることが示されました。
今後の展望:aumolertinibが承認されれば、中国本土のファーストラインの転移性NSCLCセグメントにおいて、2019年9月のTagrissoの承認に続き、2つ目の革新的な第3世代EGFR阻害剤となります。Aumolertinibが承認されれば、中国での第3世代EGFR阻害剤の使用がさらに促進されますが、Tagrissoの市場初の優位性、高い値ごろ感、およびそのジェネリック医薬品の入手可能性により、この治療法におけるAumolertinibの取り込みは制限されるでしょう。
5. 進行性肝細胞がんのファーストラインにおけるドナフェニブのソレフニブ (ネクサバール) に対する優位性を示す
ドナフェニブが進行性肝細胞がん (HCC) のファーストラインとして採用されるには、ポジティブなフェーズIIIデータがあれば十分か?
背景:ソラフェニブは、進行期肝細胞がんのファーストラインとして、世界中で長い間、他の追随を許さない標準治療となっています。しかし、ソラフェニブによる全生存期間 (OS) の延長はわずかであり、重篤な有害事象を伴います。レンバチニブを評価した第3相試験 (REFLECT) でも、ソラフェニブと比較して統計的に有意なOSの改善を示すことができませんでした。そのため、この患者には、既存の治療法よりも全生存期間の延長と安全性の向上をもたらす薬剤がアンメットニーズとして残っています。
ASCOでのアップデート:Zelgen Biopharmaceuticalsは、進行性肝細胞がんのファーストライン治療において、ドナフェニブとソラフェニブを比較した、ヘッドツーヘッドのピボタル第3相試験の結果を発表しました。その結果、ドナフェニブはソラフェニブよりも患者のOSを有意に改善し、安全性と忍容性のプロファイルも良好であることが示されました。
今後の展望:ドナフェニブがソラフェニブよりも生存期間を延長したことは心強いことですが、免疫チェックポイント阻害剤とTKI、VEGF阻害剤、CTLA-4阻害剤を組み合わせた併用療法の登場により、その効果は影を潜めることが予想されます。このような併用療法は、複数の製薬メーカーが中国の肝細胞がん市場向けに開発しています。これらの治療法の多くは、ファーストラインの進行した肝細胞がんを対象とした後期臨床試験で検討されており、このような治療環境ではTKI単独よりも優れた有効性と忍容性が期待されています。ドネフェニブがファーストライン治療で市場を大きく拡大する見込みは、ソラフェニブが市場で長く存在しているため、医師の安心感が高く、価格も手頃で、費用対効果の高いジェネリック医薬品が入手可能であることも問題となるでしょう。
6. トリパリマブが再発・転移性上咽頭がんのファーストライン治療薬として有望
良好な結果は、トリパリマブ (Junshi BiosciencesのTuoyi) のファーストラインの転移性上咽頭がん (NPC) 患者集団における適応拡大をサポートし、中国本土のPD-1阻害剤市場における国内メーカーの優位性をさらに強固なものに6
背景:2021年2月、Junshi Biosciencesは、前治療歴のない進行性転移性NPC患者の第一選択薬として、トリパリマブ (化学療法との併用) の追加NDAを申請しました。この申請は、2020年9月に発表された第3相JUPITER-02臨床試験の良好な結果に基づいています。
ASCOでのアップデート:Junshi Biosciencesは、第3相JUPITER-02臨床試験の結果を発表し、トリパリマブをゲムシタビン/シスプラチンと併用してファーストライン治療を行うことで、ゲムシタビン/シスプラチン単独に比べて優れたPFSと客観的奏効率 (ORR)、および長いDORが得られ、管理可能な安全性プロファイルを示すことを示しました。
今後の展望:トリパリマブは、すでにNPCのセカンドライン治療薬として承認されていますが、今回の適応拡大により、カムレリズマブ (AiRuiKa, 2021年6月承認) に次ぐ2つ目のPD-1阻害薬として、中国本土でアンメットニーズが高く、市場の潜在力がほとんどない再発・転移性NPCのファーストライン治療薬として使用されることになります。しかし、トリパリマブは、国家償還薬リストに含まれているにもかかわらず、camrelizumabや、ティスリズマブ (Baizean) やシンチリマブ (Daboshu) など、NPCの第3相試験で今後発売されるPD-1阻害剤との激しい競争にさらされることになります。
これらの結果と継続的な進展は、中国本土の国内メーカーが、国内のPD-1阻害剤市場を超えて、今や世界的にも影響力を増していることを証明しています。NPCの治療薬としてFDAから画期的な指定を受けたTuoyiは、中国本土で開発された治療薬の国際的な飛躍を象徴しています。
クラリベイトのオンコロジーエキスパート Amardeep Singh, Akash Saini, Gang Wang, Shuxin Baoが本記事に協力しています。
その他のがん治療のゲームチェンジャーに関するクラリベイトの見解については、ASCO 2021の分析をご覧ください。
References
- Efficacy and safety analysis of Chinese patients in monarchE: Abemaciclib combined with adjuvant endocrine therapy for high-risk HR+, HER2- early breast cancer. ASCO 2021. Abstract 522.
- Dalpiciclib versus placebo plus fulvestrant in HR+/HER2- advanced breast cancer that relapsed or progressed on previous endocrine therapy (DAWNA-1): A multicenter, randomized, phase 3 study. ASCO 2021. Abstract 1002.
- Pyrotinib as neoadjuvant therapy for HER2+ breast cancer: A multicenter, randomized, controlled, phase II trial. ASCO 2021. Abstract 574
- Randomized phase III trial of aumolertinib (HS-10296, Au) versus gefitinib (G) as first-line treatment of patients with locally advanced or metastatic non-small cell lung cancer (NSCLC) and EGFR exon 19 del or L858R mutations (EGFRm). ASCO 2021. Abstract 9013.
- Donafenib versus sorafenib as first-line therapy in advanced hepatocellular carcinoma: An open-label, randomized, multicenter phase II/III trial. ASCO 2021. Abstract 4506.
- JUPITER-02: Randomized, double-blind, phase III study of toripalimab or placebo plus gemcitabine and cisplatin as first-line treatment for recurrent or metastatic nasopharyngeal carcinoma (NPC). ASCO 2021. Abstract LBA2.