FDA藥物評估與研究中心(CDER)批准數量顯示,生物相似性藥品加速發展,創新生物藥穩步增長
本文譯自 科睿唯安 BioWorld 報導,原文作者為 Mari Serebrov
2010年美國國會首次為生物相似性藥品打開大門以來,2019年FDA就批准了與創新生物藥數量相當的生物相似性藥品產品。
隨著生物相似性藥品首個十年里程碑的臨近,2019年FDA藥物評估與研究中心(CDER)共批准了10款生物相似性藥品產品,涉及7種重磅級生物藥,截至2019年底,核准的生物相似性藥品累計已達26種。與此同時,2019年CDER還批准了12種創新生物藥,雖然低於近兩年每年批准的數量,但與這十年的最初幾年相比,CDER批准的新生物製劑許可申請(BLA)數量已是最初幾年的兩倍。
CDER批准的新生物製劑許可申請(BLA)
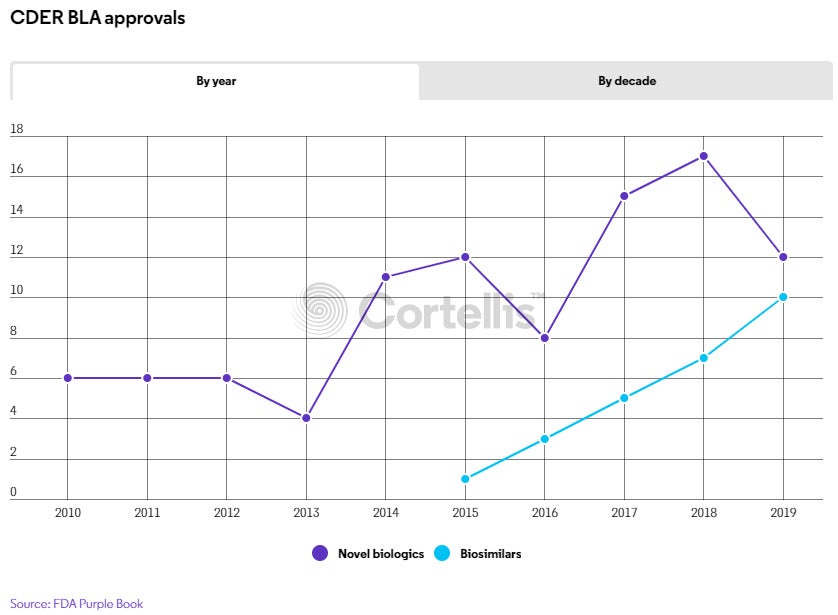
隨著生物相似性藥品產品的核准,將在這些陸續上市的產品中逐步形成市場競爭,前面提及的7種重磅級原廠生物藥,迄今至少已有一種仿製產品核准。例如,2019年批准的10種生物相似性藥品產品中有3種是羅氏(Roche Holding AG)乳腺癌藥物賀癌平(Herceptin,trastuzumab)的生物相似性藥品,而該藥此前已有兩款生物相似性藥品產品核准。
此外,2019年還新批了兩款復邁(Humira,adalimumab)的生物相似性藥品產品,致使艾伯維(Abbvie Inc.)的這一超級重磅藥品已有五款競爭產品蓄勢待發。雖然授權合約可暫時將復邁的生物相似性藥品抵擋在美國市場之外直到2023年,但賀癌平的市場競爭已於2019年拉開帷幕。未來幾年在該領域發生的變化,將為生物藥產品在其關鍵專利到期後如何參與市場競爭,提供參考與見解。
根據生物製劑價格競爭與創新法案,創新生物藥擁有12年的獨佔期,即2019年批准的BLA將到2031年才會面臨生物相似性藥品產品的競爭,除非國會在此之前縮短其獨佔期。
從美國-墨西哥-加拿大協議(USMCA)中移除擬議的10年獨佔期的同時,川普政府也為減少美國生物藥獨佔期提供了一個機會。美國眾議院已經通過了一項實施該協議的法案,參議院財政委員會也於週一以25票贊成、3票反對的投票結果將該法案送交參議院通過。
不論獨佔期的長短如何,生物相似性藥品產品的未來還是取決於強勁的生物藥市場,該市場在世紀之交已真正覺醒,並在過去十年已有98種新型生物藥核准。
由於生物相似性藥品的開發成本和市場門檻,許多生物藥不太可能面臨生物相似性藥品的競爭。根據 Cortellis 資料,到目前為止,美國市場的生物相似性藥品開發所瞄準的大多是峰值銷售額超過60億美元的大產品。
2019年核准的新型生物藥中可能就包括一些符合上述特徵的大產品。例如,根據 Cortellis 資料顯示,艾伯維的新型免疫藥物Skyrizi(risankizumab),預計到2025年銷售額將接近41.5億美元。如同2003年核准的復邁,在美國市場第七年便達到了55億美元的銷售額,甚至在2018年達到了203億美元的銷售額峰值。
2019年核准的創新生物藥
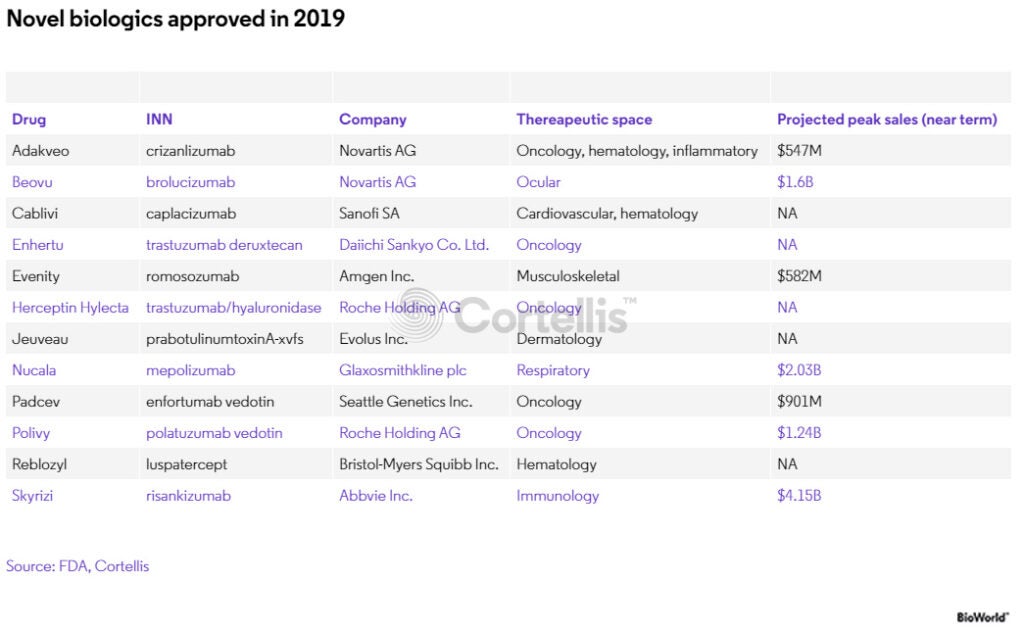
另一款創新BLA批准產品是來自羅氏的Herceptin Hylecta(trastuzumab和透明質酸酶),將為賀癌平的生物相似性藥品打開未來的大門,通過新的配方與組合延續此藥物的生命週期。
儘管2019年批准的新型生物藥的數量較2017年、2018年有所減少,但仍占2019年CDER批准的48個新分子實體的25%。2018年是新藥創紀錄的一年,CDER批准的59種新藥中有17種是生物藥,占比近29%。
對比2018年與2019年,最大的區別在於孤兒藥批准數量的下降,無論是小分子藥物還是生物藥。2019年CDER批准了21種孤兒藥,而2018年批准了35種,儘管數量有所下降,但核准的21種罕見病藥物仍占2019年新藥批准總數的44%。
近10年核准的孤兒藥
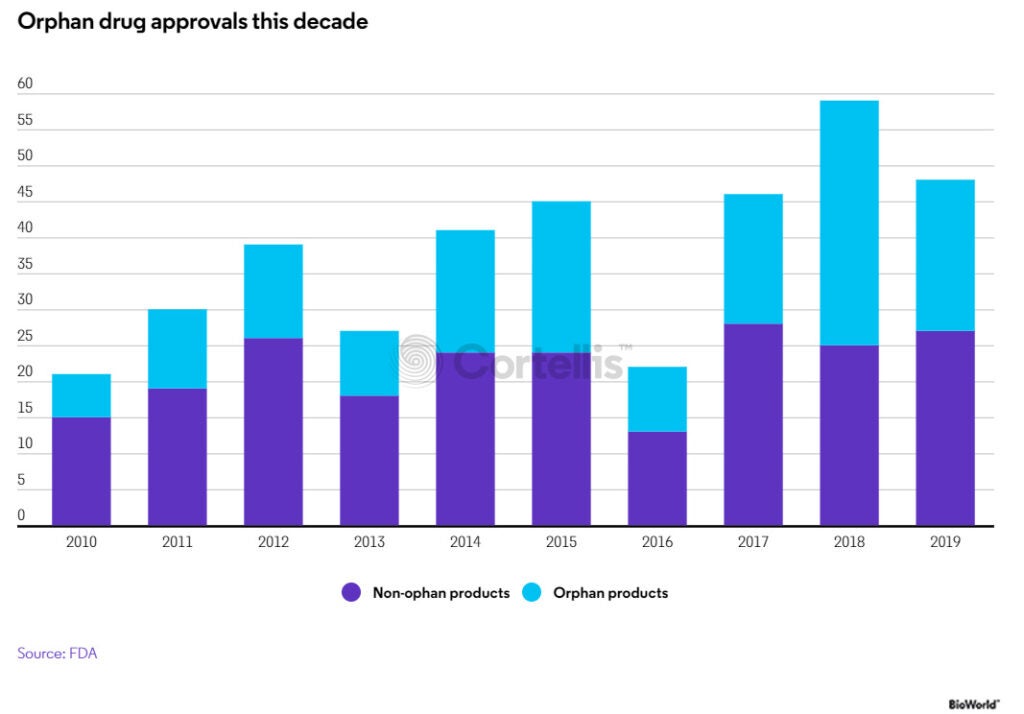
CDER主任Janet Woodcock指出,「與往年相比,CDER批准的孤兒藥數量顯著增加。」她補充道:「在剛剛過去的八年中,CDER批准的孤兒藥數量是在此前八年的兩倍多。」2012年至2019年,CDER共批准了142種創新孤兒藥,而2004年至2011年僅有63種。





