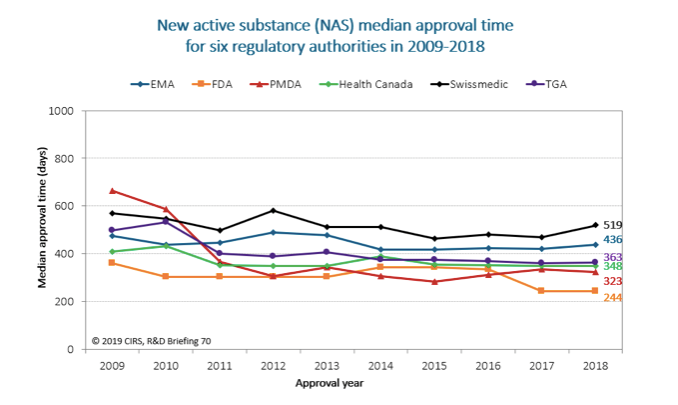
醫藥法規監管環境的明顯改善以及跨國公司新藥申報的策略變化,使獲得藥證所需的時間普遍減少,六大監管機構之間的協調統一性也有所提升,過去10年 (2009-2018)裡獲准上市的新藥數量也有所成長。六大監管機構包括歐洲藥品管理局 (EMA)、美國食品藥品監督管理局 (FDA)、日本藥品和醫療器材管理局 (PMDA)、加拿大衛生部、瑞士醫藥管理局 (Swissmedic)和澳洲藥品管理局 (TGA)。
科睿唯安下的國際法規科學創新研究中心 (CIRS)在題為《2009-2018年六大監管機構核准的新藥:關注加速審查通道和孤兒藥狀態》的研發報告中發佈了一項新研究,該研究對新活性物質 (New active substance, NAS)的獲准情況進行統計,有如下發現:
更多的產品實現了國際化的申請策略
CIRS的統計表明,六家監管機構核准的藥品數從2009-2013年間的16個NAS成長至2014-2018年間的52個NAS,這表明在此階段內,有更多的產品實現了國際化。
影響新藥提交申請並獲得監管機構核准總時間的潛在影響因素包括:公司策略、審查計劃的類型和實施、產品類型及其治療領域。特別是加速審查通道 (FRP)、孤兒藥資格和申請人規模是影響提交和核准的主要因素。
關注加速審查通道
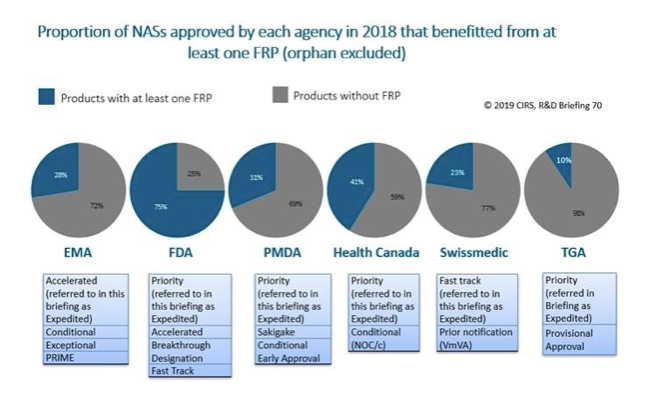
六家監管機構均已實施一種特定的加速審查通道,即旨在加速有前景新活性物質審查進程的加速審查計劃(指EMA的「加速審查」、Swissmedic 的「綠色通道」和另外四家監管機構的「優先審查」)。TGA自2017年開始實施優先審查體系,2018年第一次透過該體系核准新藥。一般而言,透過加速審查計劃所需的時間短於標準計劃。
2018年,FDA (73%)加速審查所占的比例最高,其次為加拿大衛生部 (35%)、PMDA (28%)、Swissmedic (13%)、EMA和TGA (10%)。
六家監管機構中,FDA提供(或可用)的加速審查通道 (FRP)最多,包括:未滿足醫學需求的領域、加快藥品的審查和/或核准,以提高藥品的可及性。2018年,FDA核准的NAS中有75%的藥品至少從一種可用的FRP中(不包括孤兒藥)獲益。其他機構中,FRP的應用比例在TGA的10%至加拿大衛生部的41%之間(見圖2)。
關注孤兒藥狀態
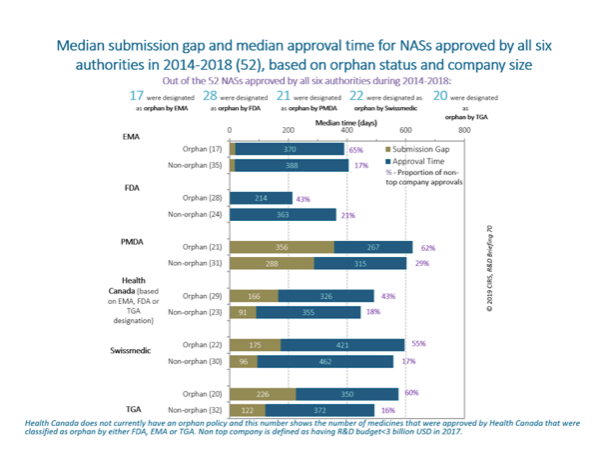
六家監管機構取得孤兒藥資格的NAS數量從2009-2013年的25%提高至2014-2018年的38%。2018年,FDA核准的孤兒藥最多 (35),而PMDA的最少 (8)。加拿大衛生部現在尚未執行孤兒藥政策;但是,該機構2018年核准了15個FDA、EMA或TGA具有孤兒藥資格的NAS。
2018年,FDA的孤兒藥中位核准時間最短(243日),其中88%的藥品均透過加速審查獲准。六家監管機構中,只有EMA的孤兒藥中位核准時間超過非孤兒藥。2018年 Swissmedic 的這些時間指標接近。2018年 TGA 核准的孤兒藥中,20%透過剛啟動的優先審查計劃獲准。
2014-2018年獲得六家監管機構核准的52個NAS藥品中,只有10個NAS藥品在所有監管機構中被指定為孤兒藥,表明各監管機構間指定孤兒藥的標準有一定差異。一般而言,孤兒藥NAS的中位提交時間差長於非孤兒藥NAS。
事實上,大部分孤兒藥NAS都是由非頂尖企業註冊的,突顯小藥廠在推動創新的重要性。
[註] 國際法規科學創新研究中心是科睿唯安旗下的一家位於英國的獨立運營分支機搆





