![]()
RUCHITA KUMAR 박사
시니어매니저, 헬스케어 리서치 및 데이터 분석부, China In-Depth
Clarivate
최근 수년간 중국은 처방전이 필요한 약물에 대한 검사 및 승인에 관한 규제 프로토콜을 간소화했고 이에 따라 중국내 및 해외 제약회사에서 생산되는 수십개의 약물들이 긴급한 치료가 필요한 환자들에게 쓰일 수 있게 되었습니다.
지난 5년동안, 중국의 헬스케어 리더들은 서구시장과 중국내 신약 가용성을 비교한 후 이 시간을 줄이기 위해 부단한 노력을 쏟았습니다. 중국에서 약물 승인 속도를 높이는데 가장 큰 장애물은 글로벌 임상시험에서 생성된 임상증거들을 보완하기 위해 중국내에서 임상시험을 수행해야 한다는 엄격한 등록 요건이었습니다. 이를 해결하기 위해, 2017년 의약품 평가센터(Center for Drug Evaluation: CDE)는 여러 센터 연구에서 생성된 임상 증거에 기초해 시판신청을 가능케하겠다고 발표했습니다.하지만 신약 또는 라벨 확장에 대한 승인을 얻기 위해서 약물개발자들은 CDE에서 제시한 특정 요구 사항을 충족시켜야 했습니다.
이듬해에는, 중국정부는 국무원(SC)과 국가보건 위원회(NHC)의 전문가로 구성된 실무 위원회를 소집해 서구 시장에서 이미 승인된 의약품과 중국에서 긴급하게 필요한 의약품을 식별했습니다. 식별된 약물들은 희귀병 또는 심각하게 생명을 위협하는 질병이지만 치료옵션이 없었던 곳에 쓰이는 약물들과 심각하게 생명을 위협하는 질병상태에 놓인 환자들에게 뚜렷한 이점을 제공하는 약물들이었습니다.이와 동시에 CDE는 이런 승인을 쉽게 할 수 있도록 특별채널을 구축했습니다. 3년동안 워킹 그룹은 81개 약물 목록(3개 배치로 출시)을 발표했으며, 이 약물들 중 절반 이상이 효과적인 치료옵션이 부족한 희귀 적응증 관리를 위한 약물이었습니다. 또한, 이 약물들 중 60%이상이 추후 의도한 적응증에 대한 승인을 받았으며, 이런 현상은 이런 시장에서 보다 효과적이고 새로운 치료법이 필요함을 시사합니다.
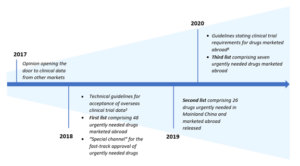
그림 1. 중국에서 긴급하게 필요한 의약품에 대한 빠른 접근을 위해 취해진 주요 조치들
승인 프로세스를 보다 가속화하기 위해 2020년 CDE는 워킹그룹에 의해 식별된 약물에만 국한시키지 않는 보다 확대된 접근법을 채택했습니다. CDE는 또한, 해외 약물을 위한 임상시험요건에 대한 지침을 발표했습니다. 가이드라인에 따르면 검토 프로세스의 기본 목표는 대상 모집단에서 제품의 안정성과 유효성을 확립하는 것이지만, 기존 임상 증거들이 중국 내의 환자에 대한 사용의 근거가 될지 또는 추가 데이터가 필요한지에 대한 결정은 위해성-유익성 평가의 결과에 기초할 것입니다.

클래리베이트의 연구에 따르면 많은 환자들- 특히 희귀 질환을 앓고 있거나 기존 치료 옵션이 효과가 없는 환자가 개정된 조항의 혜택을 받았습니다.
| 적응증 | 분자 | 브랜드 | 회사명 | 승인년도 | 라벨 | 임상적 근거 |
| 다발성 경화증(MS) | Fingolimod | Gilenya | Novartis | 2019 | MS의 재발성 형태 | 다발성 경화증은 중국에서 희귀병으로 지정되었으며 중국 최초 희귀질환 목록(CRDL)에 올라있음. 서구시장에서 여러 DMT를 사용할 수 있음에도 불구하고 2018년 이전에 중국에서 DMT가 부족함. |
| Dimethyl fumarate | Tecfidera | Biogen | 2021 | |||
| Ofatumumab | Kesimpta | Novartis | 2021 | |||
| Ozanimod | Zeposia | Celgene | 2023 | |||
| 호산구 증가증 육아종 다발혈관염 (EGPA) | Mepolizumab | Nucala | GSK | 2021 | EGPA 성인 환자 | EGPA는 생명을 위협하는 희귀한 자가면역질환임. 근본적인 질병병리를 다루는 이용가능한 치료옵션이 부족함. |
| 혈구탐식 림프조직구증 (HLH) | Emapalumab | Gamifant | Swedish Orphan Biovitrum AB | 2022 | 난치성 또는 재발성 HLH 환자 | HLH 는 매우 희귀한 고도로 진행되는 과염증성 질환임. HLH와 관련된 치료제로 승인된 약물이 없으며 사망률이 높음(30-40%). |
| 유방암 | Pembrolizumab | Keytruda | Merck | 2022 | 종양이 PD-L1 (CPS ≥20)을 발현하는 고위험 초기 삼중 음성 유방암 환자(TNBC) | 초기 TNBC관리에 사용할 수 있는 효과적인 치료옵션이 부족함. 사례의 30%~40%는 표준 치료 후 후기라인으로 진행. |
| 난소암 | Bevacizumab | Avastin | Roche | 2021 | Paclitaxel /cisplatin 또는 paclitaxel/topotecan을 병용한 백금 내성, 재발성 또는 전이성 자궁경부암 환자. | 화학요법은 재발 불응환자를 위한 표준 1차 치료옵션임. 그러나 임성적 이점은 제한적이며 많은 환자가 약물을 견딜 수 없음. |
| 전립선암 | Olaparib | Lynparza | AstraZeneca | 2021 | BRCA 돌연변이가 있는 전이성 거세 저항성 전립선암(mCRPC)을 가진 성인환자로 이전에 호르몬 요법으로 치료한 후 병증이 진행된 환자. | 1차 치료에서 이미 호르몬 요법치료를 받은 말기 mCRPC환자에게 사용할 수 있는 효과적인 치료옵션이 부족함. |
표 1. 해외 임상 증거를 기반으로 중국 본토에서 주요 승인/라벨확장이 된 일부 적응증 (출처: CDE.org, 클래리베이트 분석자료)
윈윈 상황
지역관리들은 중국내에서 혁신적인 치료법에 보다 빨리 접근할 수 있는 강력한 승인 프로세스를 구축하기 위해 지속적으로 노력하는 동시에 이런 치료법을 국가 환급 의약품 목록 (NRDL)에 포함시켜 이런 치료법에 대한 환자 접근성 및 경제성을 개선하기 위해 동시에 노력하고 있습니다. Huiminbao (상업 보험으로 보충)와 같은 다른 혁신적인 채널을 통해 액세스가 가능합니다. 또한, NMPA는 파일럿 지역에서 생성된 실제 임상 증거를 기반으로 긴급하게 필요한 수입의약품 승인을 용이하게 할 수 있도록Hainan Boao Lecheng와 같은 국제 의료 관광 파일럿 지구를 설립했습니다.
최근의 개혁 및 조항을 종합해보면 다음과 같습니다.:
- 중국에서 많은 혁신적이고 개선된 치료법에 대한 보다 빠른 접근을 촉진
- 특히, 기존 치료옵션으로 치료가 되지 않거나 치료옵션이 부족한 틈새 환자군을 위한 치료옵션의 수를 증가시킴.
- 다국적 기업(MNCs)이 다양한 채널을 통해 매우 수익성이 좋은 시장에 진입할 수 있도록 허용
클래리베이트의 Disease Landscape and Forecast 보고서가 중국 및 기타 시장에서 시장 점유율을 극대화하고 장기적인 질병 전략을 어떻게 최적화 시킬 수 있는지 알아보고 싶다면 이곳을 방문해 알아보십시오.
레퍼런스:
Opinion on deepening the reform of the review and approval system and encouraging the innovation of drugs and medical devices, October 2017.
Opinion on the list of new drugs marketed overseas urgently needed in China, August 2018.
First list of overseas new drugs urgently needed in clinical practice, November 2018.
Second list of overseas new drugs urgently needed in clinical practice, May 2019.
Third list of overseas new drugs urgently needed in clinical practice, November 2020.
Clinical technical requirements for overseas drugs not yet imported to China, October 2020.


