先日開催されたウェビナー「Trends in Clinical Trial Planning」の準備として、クラリベイトグループのCentre for Medicines Research(CMR)Internationalが独自に収集したデータをもとに、世界の大手製薬企業と共同で研究開発の計画と有効性を強化するための業界トレンドに関するインサイトを提供しました。
臨床試験の期間の長さは、業界の関心事であり続けています。臨床試験期間の短縮は、市場投入までの時間を短縮し、コストを削減し、治療を必要とする患者さんに治療の選択肢を提供することを意味します。業界が臨床試験の期間短縮に向けた取り組みを続ける中で、長期的な傾向を評価することで、戦略の有効性を監視し、必要に応じて適応することが可能になります。
30社が2019年のCMR Internationalプログラムに参加し、8,000以上の化合物、35,000以上の試験、100,000以上の国、64万以上のサイトレベルの記録に関するデータを提供しました。
開発期間
このデータによると、全体的な開発時間(複合コードからファーストワールドローンチに割り当てられた時間)は、過去10年間で減少していることがわかります。実際、2019年の開発時間は2013年以降で最も短くなっています。しかし、Figure 1に示すように、過去7年間の改善は基本的に停滞しています。個々のフェーズを詳しく見てみると、フェーズ1とフェーズ2の2019年の総試験期間は、2013年と比較してそれぞれ21%と2%減少していますが、フェーズ3の試験期間は8%増加しています。
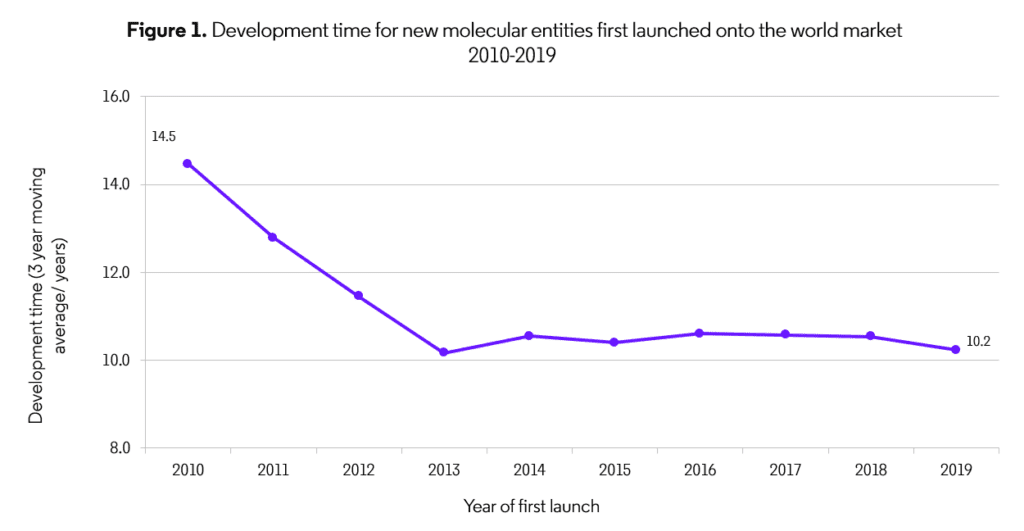
出典: The Centre for Medicines Research
*2019年の開発時間データポイントは、2018年と2019年のデータのみを含む
第3相試験は通常、意図された適応症とレシピエント集団において治療上の有益性と安全性を実証または確認することを主な目的としているため、必要とされるサンプル数は第1 相試験や第 2 相試験よりも多くなっています。したがって、患者登録が試験期間に及ぼす影響については、より詳細に検討する必要があります。
制限要因としての登録
実際、参加者登録は、特に第3相臨床試験では、臨床試験間隔が最も長く(Figure 2)、試験期間の制限要因となっており、これは改善の余地のある分野です。
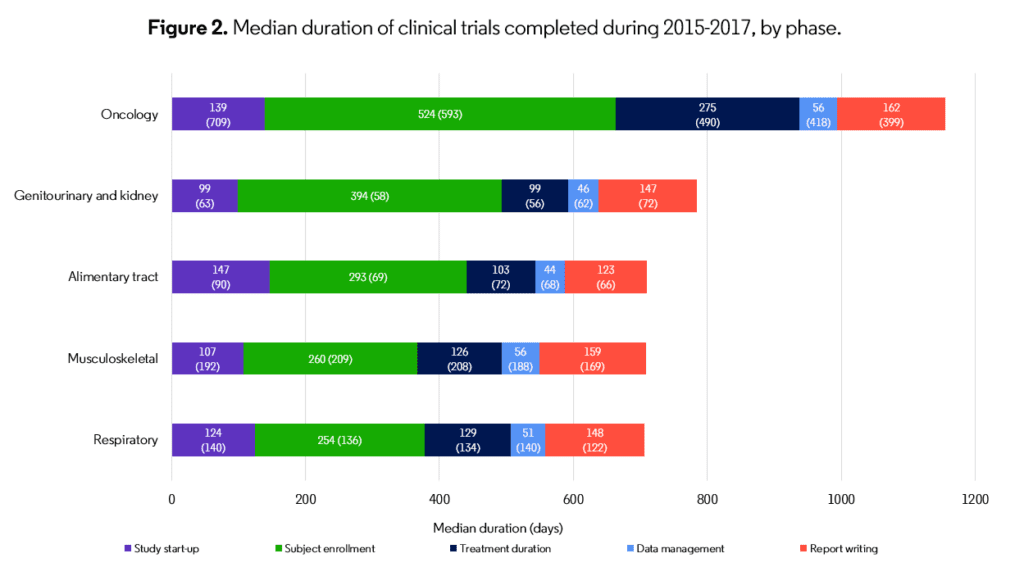
出典:The Centre for Medicines Research
すべての試験段階において、試験プロトコールの53%は試験開始後に修正が必要で、修正の大部分は登録間隔中に行われています(Figure 3)。したがって、試験デザインの段階で患者の特定と層別化戦略を改善することで、登録を改善し、修正の必要性を減らし、試験のタイムラインを短縮することができます。
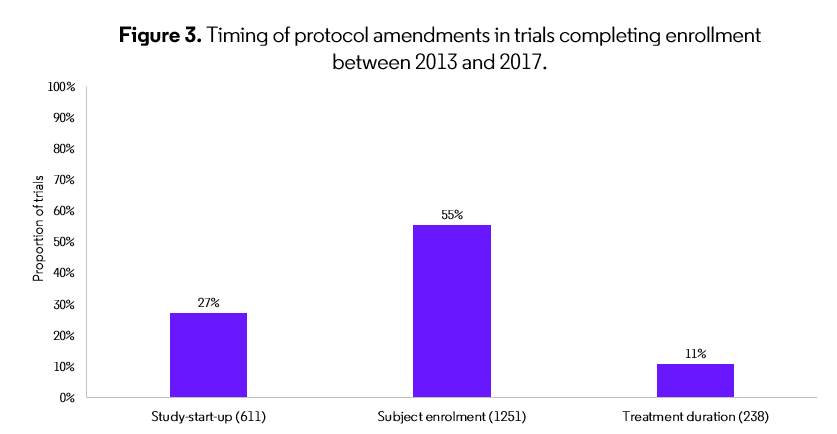
出典: The Centre for Medicines Research
マスタープロトコルとバイオマーカー主導の層別化
ゲノミクスを用いて適格性基準を定義し、選択することは、バスケット試験やアンブレラ試験を含むバイオマーカー誘導型臨床試験の一般的な特徴です。これらのデザインはマスタープロトコルの枠組みに属し、遺伝子、環境、およびライフスタイルの個人差に基づいて、特定の治療に最も反応する可能性の高い患者を特定することにより、精密医療の考え方に従っています。
バイオマーカーを用いて患者を層別化することで、患者と治療法の適合性を確保し、離脱率を低減し、試験の成功確率を、バイオマーカーによる層別化を行わない試験の約2倍にまで高めることが可能です(10.3% vs 5.5%)1。
バイオマーカーを用いて参加者を選択すると、試験の成功率が5.5%から10.3%に増加する。
試験の場所と経験豊富な施設
もう一つの戦略は、関心のある疾患の患者数が多い国を特定することですが、これは規制当局の審査や承認に伴う複雑さやタイムラインとのバランスをとる必要があります。
治験施設は、臨床試験における患者の特定、募集、登録において重要な役割を果たします。そのため、選択した患者層の採用経験のある施設を選択することで、効率性を高め、適切な患者層へのアクセスを確保することができます。Cortellis のようなデータは、特定の患者セグメントの登録実績や、遺伝子バリアントのレベルに至るまで、治験実施施設の情報を提供してくれるため、治験実施施設の選択が容易になります。
データを活用して洞察力を高め、市場投入までの時間を短縮
Centre for Medicines Researchで入手できるような集約されたデータソースを活用することで、研究開発や臨床プログラムのベンチマークを行い、社内のKPIを設定し、より戦略的な試験計画の決定を行うことができます。業界は臨床試験の期間を短縮し、市場投入までの時間を短縮することを目指していますが、トレンドを継続的に評価することで、新しい戦略の有効性を監視し、業界最大の課題に戦略的に対処することが可能になります。
Centre for Medicines Researchは、20年間の厳格な開発を経て構築された業界指標とトレンド分析の客観的な情報源であり、将来の計画を立て、業界とのベンチマークを行っています。
References
- Wong CH, Siah KW, Lo AW. Estimation of clinical trial success rates and related parameters. Biostatistics. 2019;20(2): 273–286. https://doi.org/10.1093/biostatistics/kxx069




